Moleculaire en cellulaire neurobiologie
Moleculaire en cellulaire neurobiologie

Fosfolipidederivaten: nieuwe perspectieven in de geneeskunde
Neuronale membranen bestaan hoofdzakelijk uit fosfolipiden en deze vormen op hun beurt de fysisch-chemische omgeving voor membraaneiwitten zoals receptoren. Bovendien zijn neurotransmitters aanwezig in fosfolipide blaasjes, zodat afgifte en heropname grotendeels afhankelijk zijn van de intacte rangschikking van de fosfolipiden. Tenslotte spelen fosfolipiden en hun vetzuurbestanddelen zelf een centrale rol in tal van signaleringssystemen van de cel.
Recente bevindingen tonen aan dat fosfolipiden overvloediger aanwezig zijn in het CZS-weefsel na hersenletsel en degeneratieve hersenziekten. De afstotende eigenschappen van deze fosfolipiden zouden de regeneratie negatief kunnen beïnvloeden. De regulatie van fosfolipide-geïnduceerde signaalcascades, die onder andere de terugtrekking van neurieten in gang zetten, zou een mogelijk nieuw uitgangspunt kunnen zijn voor therapeutische strategieën na acuut craniocerebraal trauma, maar ook bij neurodegeneratieve ziekten zoals de ziekte van Alzheimer, de ziekte van Parkinson en multiple sclerose. Tot op heden hebben we geen effectieve geneesmiddelen en therapeutische strategieën om neurodegeneratieve ziekten te genezen. De huidige therapeutische interventies komen te laat in de neurodegeneratieve cascade, het degeneratieproces kan slechts met moeite worden gestopt en zelfs de redding van de nog aanwezige neuronen kan niet leiden tot een restitutio ad integrum. Hier is meer gedetailleerde kennis nodig van de mechanismen die kunnen leiden tot de regeneratie van zenuwvezels om gerichte diagnostische biomarkers te kunnen gebruiken voor de vroege opsporing van neurodegeneratieve ziekten, en om nieuwe therapeutische strategieën te kunnen ontwikkelen om specifiek in te grijpen in de regulatie van de axonale uitgroei.
Aan plasticiteit gerelateerde genen
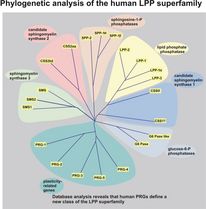
De Bräuer-afdeling werkt al verscheidene jaren aan de identificatie van moleculaire mechanismen tijdens de neuronale ontwikkeling en bij de- en regeneratieprocessen in het volwassen centrale en perifere zenuwstelsel. Bräuer en collega's identificeerden een nieuwe hersenspecifieke klasse van eiwitten, de LPPRs/PRGs (Strauss & Bräuer, 2013; Brindley & Bräuer, 2010; Bräuer & Nitsch, 2008). Deze komen ontwikkelingsgericht tot expressie en zijn betrokken bij remodelleringsprocessen in het CZS en het PNS door fosfolipiden te modificeren of door te interfereren met hun signaalwegen (Coiro et al., 2014; Velmans et al., 2013, Trimbuch et al., 2009; Peeva et al., 2006; Savaskan et al., 2004). Gegevens over de functionele relevantie van fosfolipiden wijzen op een regulerende rol in de neuronale transmissie (Trimbuch et al., 2009), waarvan de mechanismen momenteel worden opgehelderd. De temporele en ruimtelijke regulering van fosfolipiden is een gevoelig proces dat in hoofdzaak afhangt van lipide fosfatasen, de fosfolipidenreceptoren en de autocriene motiliteitsfactor ATX. Bräuer en collega's konden ATX-expressie aantonen tijdens de ontwikkeling en in de volwassen hersenen in oligodendrocyte progenitorcellen (Savaskan et al., 2007). Bovendien werd de opregulatie van ATX aangetoond in reactieve astrocyten na hersentrauma (Savaskan et al., 2007). Aangezien ATX lysofosfatidylcholine (LPC) hydrolyseert tot LPA, suggereert deze eiwitexpressie dat een verhoogde LPA-synthese ook optreedt na hersenletsel.
Cellulaire en moleculaire mechanismen van neurodegeneratie: betrokkenheid en rol van sfingolipiden
Veranderde regulatie van glycosfingolipiden (GSL), specifiek gangliosiden, wordt in verband gebracht met misvouwing en aggregatie van eiwitten die geassocieerd worden met neurodegeneratie. GSL verwijst naar een groep lipiden ("sfingolipiden" genoemd) die betrokken zijn bij de assemblage van celmembranen. Gangliosiden worden voornamelijk aangetroffen in de celmembranen van cellen van het centrale zenuwstelsel. Daar vervullen zij, via hun koolhydraatgroep, taken in de interactie tussen afzonderlijke cellen, zoals signaaloverdracht. Het is bekend dat de abnormale accumulatie van gangliosiden een sleutelrol speelt in de pathogenese van verschillende ziekten, zoals de ziekte van Sandhoff, Tay-Sachs en de ziekte van Gaucher. Stapeling van gangliosiden is ook een gemeenschappelijk kenmerk van schijnbaar zeer verschillende neurodegeneratieve ziekten zoals Niemann-Pick type C1 (NPC) en de ziekte van Alzheimer (AD). NPC is een lysosomale lipidenopslagziekte die op autosomaal recessieve wijze wordt overgeërfd. In Duitsland zijn slechts ongeveer 500 - 700 gevallen van de ziekte bekend (Vanier, 2010). Deze ziekte is dus een van de zeldzame ziekten. De mutatie in het NPC1-gen leidt tot een stoornis in het cholesterolmetabolisme die, via een onbekend mechanisme, leidt tot progressieve neurodegeneratie, vooral van de Purkinje-cellen in de kleine hersenen. Naast de afzetting van cholesterol is er ook de afzetting van glycosfingolipiden, sfingomyeline, sfingosines en, vooral in neuronen, de ophoping van gangliosiden. De ziekte leidt altijd tot de dood, aangezien er tot op heden geen curatieve therapie bestaat. Miglustat is sinds 2009 als geneesmiddel goedgekeurd, maar het vertraagt de ziekte slechts. Naast de accumulatie van gangliosiden vertonen beide ziekten, NPC en AD, de ontwikkeling van dezelfde structurele neuropathologieën, zoals oligomerisatie en fibrilvorming van amyloïd-β en tau (Malnar et al., 2014). Het belang van neuronale glycoshingolipidestapeling als drijvende kracht van neurodegeneratie werd ook aangetoond bij de identificatie van een genetische associatie tussen de ziekte van Parkinson en de ziekte van Gaucher (Sidransky et al., 2009).De invloed van het sfingolipidemetabolisme, de signaalweg ervan en de wisselwerking tussen de eiwitten die erbij betrokken zijn op neurodegeneratie is momenteel nog grotendeels onbegrepen. Eerdere studies in het AG Bräuer tonen aan dat de expressie van de S1P-receptor is veranderd in NPC-/- muizen versus WT muizen in qRT-PCR. Deze gegevens zullen nu het uitgangspunt vormen voor verdere gedetailleerde moleculaire en celbiologische studies, alsook voor de vergelijking van de receptorexpressie in NPC muizen met die in AD muizen. Eén aandachtspunt zal het onderzoek van S1P3 en S1P5 zijn, aangezien ons voorbereidend werk een toename van S1P3 mRNA en een afname van S1P5 mRNA-expressie in NPC-/- muizen aantoont.
De rol van PRG5 in de ontwikkeling van de doornuitsteeksels
Neuropsychiatrische ontwikkelingsstoornissen, zoals autismespectrumstoornissen of schizofrenie, worden in verband gebracht met abnormale dendritische spineprocessen en synapsontwikkeling. Helaas is er weinig bekend over de moleculaire mechanismen die betrokken zijn bij zowel de fysiologische als de pathologische vorming van dendritische doornige processen. Het doel van dit project is om een nieuwe kandidaat, PRG5 (Plasticity Related Gene 5), die we recent geïdentificeerd hebben, functioneel te analyseren op zijn rol tijdens de ontwikkeling van dendritische spinous process. Meer specifiek willen we de moleculaire mechanismen en signaalwegen van PRG5 identificeren en nieuw ontdekte bindingspartners en hun functie in het proces van hersenveroudering onderzoeken. Wij weten reeds dat endogene PRG5 eiwitniveaus een rol spelen in de correcte ontwikkeling van dendritische doornuitsteeksels, hun morfologie en de stabilisatie van excitatoire synapsen. Bovendien hebben wij aangetoond dat de C-terminus van PRG5 bij deze mechanismen betrokken is, waarschijnlijk door plaatselijke binding van lipiden. Aangezien veranderingen in de doornuitsteeksels zijn aangetroffen bij veel verschillende pathologische processen, waaronder neurodegeneratieve en neuropsychiatrische ziekten, kan PRG5 van groot belang zijn voor de vatbaarheid, pathologie of therapie van dergelijke ziekten. Onze technieken combineren het gebruik van transgene muismodellen, primaire zenuwcelculturen en in vivo manipulaties van verschillende signaalwegen bij muizen door middel van de in utero-elektroporatietechniek. Deze uitstekende combinatie van methoden zal ons in staat stellen nieuwe signaalwegen te identificeren die betrokken zijn bij de ontwikkeling van de hersenen, niet alleen voor cellulaire processen of netwerkfuncties, maar ook voor pathologische veranderingen in het gedrag van muizen, waardoor een eenduidig beeld ontstaat van hoe neuropsychiatrische ontwikkelingsstoornissen ontstaan.


