Quantenchemie
Kontakt
Prof. Dr. Thorsten Klüner
Institut für Chemie
Arbeitsgruppe Theoretische Chemie
Quantenchemie
Quantenchemie
Die zugrundeliegenden physikalischen Gesetze, die für die mathematische Theorie eines großen Teils der Physik und der gesamten Chemie notwendig sind, sind also vollständig bekannt, und die Schwierigkeit besteht nur darin, dass die exakte Anwendung dieser Gesetze zu Gleichungen führt, die viel zu kompliziert sind, um lösbar zu sein.
P. A. M. Dirac
Schon bevor Dirac das Problem 1929 auf den Punkt brachte, war Forschenden im Fach Chemie klar, dass die klassische Physik das Verhalten von Materie im allerkleinsten Maßstab – auf Ebene der Atome und Elektronen – nicht beschreiben konnte. Neue, teils bizarre Konzepte entstanden: Energiequanten, Welle-Teilchen-Dualismus, Unschärferelation. Mit der Formulierung der Schrödinger-Gleichung Mitte der 1920er Jahre schien die fundamentale mathematische Beschreibung für die mikroskopische Welt gefunden.
Die Frage war formuliert.
Quantenmechanik: Eine für die Chemie vielversprechende Theorie
Die Physiker*innen konnten einfache Systeme wie das Wasserstoffatom bald erfolgreich beschreiben und obwohl Heitler bereits 1931 schrieb: "Die jüngste Frucht physikalischer Forschung, die Quantenmechanik, feiert jetzt ihr fünfjähriges Bestehen. Sie beansprucht, die gesamten Erscheinungen der atomaren Welt zu beherrschen, und der Chemiker [hic!] muss sich, will seine Wissenschaft möglichst fruchtbar betreiben, mit den Ergebnissen der Quantenmechanik vertraut machen.“, blieb die Quantenmechanik für die Chemie lange Zeit eine vielversprechende, aber doch unanwendbare Theorie.
Chemische Systeme, selbst kleine Moleküle, bestehen aus vielen Elektronen und Atomkernen, die miteinander wechselwirken. Die exakte(!) Lösung der quantenmechanischen Gleichungen für solche Vielteilchensysteme war – und ist im Prinzip bis heute für große Systeme – rechnerisch unmöglich. Die Antwort auf Diracs Frage schien in weiter Ferne.
Dass die Quantenmechanik letztendlich Anwendung in der Chemie fand, ist Pionier*innen der Computerentwicklung wie Conrad Zuse zu verdanken, welcher mit dem Zuse Z3 den ersten funktionalen Digitalrechner der Welt entwickelte. Über die Jahrzehnte erreichten Computer Rechenkapazitäten, die es Wissenschaftler*innen erlaubten, die quantenmechanischen Gleichungen für komplexe chemische Systeme zumindest näherungsweise zu lösen. Dies war die Geburtsstunde der modernen Quantenchemie.
Quantenchemie: Eine Anwendung der Quantenmechanik auf chemische Problemstellungen
Die Chemie wird oft verstanden als die Wissenschaft hinter den Fragen,
- wie Atome miteinander reagieren und sich zu Molekülen verbinden,
- wie Moleküle untereinander wechselwirken und
- welche Eigenschaften die daraus entstehende Materie besitzt.
Bis heute verlässt man sich dabei oft auf Modelle und Konzepte, deren inhärentes Problem G. Box 1976 so treffend formulierte: "Im Prinzip sind alle Modelle falsch, aber manche sind nützlich.“.
Valenzbindungstheorie, Lewis-Formeln und mesomere Grenzstrukturen versuchen, die Elektronenverteilung in einem Molekül durch „Bilder“ zu beschreiben. Quantenchemisch betrachtet sind dies oft nur einzelne Terme oder Beiträge zu einer viel komplexeren Gesamtwellenfunktion, die alle möglichen Elektronenzustände gleichzeitig umfasst.
Die computergestützte Quantenchemie liefert uns nun das Werkzeug, um tiefer zu blicken. Sie berechnet die Wellenfunktion und daraus abgeleitete Eigenschaften wie Energien, Geometrien, Ladungsverteilungen oder spektroskopische Fingerabdrücke direkt aus den fundamentalen quantenmechanischen Gesetzen. Die Hartree-Fock-Methode verwandelt das Problem der Lösung der Schrödingergleichung für Mehrelektronensysteme in ein für Computer leicht handhabbareres algebraisches Problem in Matrixform, das iterativ gelöst werden kann. Diese Methode bildet das quantitative theoretische Fundament des in der gesamten Chemie oft verwendeten Orbitalmodells.
Für exakte Beschreibung chemischer Fragestellungen ist die Hartree-Fock-Methode (und damit das Orbitalmodell) allerdings nicht ausreichend. Obwohl für viele Systeme dieser Ansatz bereits 99% der exakten Energetik erfasst, müssen für die Beschreibung von Systemen mit chemischer Genauigkeit, Verfahren entwickelt und angewandt werden, die über das Orbitalmodell hinausgehen. Diese sog. Post-Hartree-Fock-Methoden (entweder wellenfunktionsbasiert oder im Rahmen der Dichtefunktionaltheorie) ermöglichen es uns heute nicht nur, experimentelle Ergebnisse zu interpretieren, sondern auch, chemische Systeme und Prozesse vorherzusagen und zu verstehen, die experimentell schwer zugänglich sind.

Die Simulation einer Diels-Alder-Reaktion mit dem Programmpaket Gaussian
Quantenchemie an der Carl von Ossietzky Universität Oldenburg
Der Forschungsschwerpunkt der Quantechemie am Institut für Chemie der Carl von Ossietzky Universität Oldenburg liegt darin chemische System und Prozesse vorherzusagen und sie zu verstehen, insbesondere diese, die schwer zugänglich sind. Dazu unter anderem die Simulation dynamischer Prozesse wie der laserinduzierten Desorption und Reaktion von Molekülen auf Festkörperoberflächen.

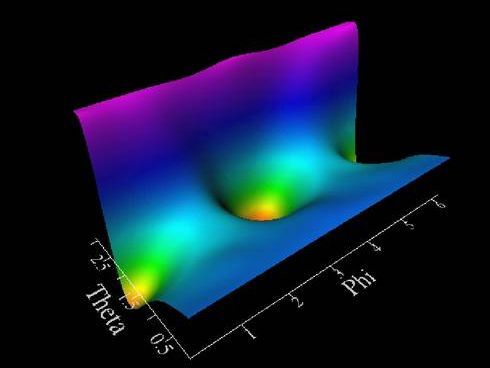
Ausbreitung eines Wellenpakets auf dem angeregten Zustand einer Potentialhyperfläche von NO/NiO(100)
Durch die Entwicklung eines hochdimensionalen Wellenpaketcodes können wir die Bewegung von Atomen und Molekülen auf Potentialhyperflächen präzise modellieren. Dies erlaubt die Untersuchung komplexer nicht-adiabatischer Effekte und den Einfluss externer Felder wie Laserpulsen und die Beschreibung offener Quantensysteme (unter Berücksichtigung von Energiedissipation und Dekohärenz) und der optimalen Kontrolle dieser Systeme.
Die Simulationen, basierend auf quantenmechanischen ab initio-Berechnungen der Potentialenergieflächen, ermöglichen ein grundlegendes mechanistisches Verständnis experimenteller Beobachtungen. Die Weiterentwicklung und Parallelisierung dieser quantenmechanischen Simulationsmethoden auf Höchstleistungscomputern erlaubt die Untersuchung immer komplexerer Systeme und eröffnet neue Einblicke in grundlegende chemische Prozesse an Festkörperoberflächen.