Kontakt
Leitung
Anschrift
Projekte
Aktuelle Schwerpunkte unserer Forschung:
Ultraschnelle Zeitverarbeitung im Innenohr: Wie geht das?
Hören ist der Sinn mit der höchsten zeitlichen Auflösung. Die Nervenfasern, die auditorische Information vom Innenohr zum Gehirn übertragen, melden den zeitlichen Verlauf eines Reizes mit unglaublicher Präzision. Dies gilt für Mensch und Tier. Der Rekordhalter unter den Tieren ist hierbei die Schleiereule, ein nächtlicher Beutegreifer. Die Hörnervenfasern der Eule kodieren den Zeitverlauf eines Geräuschs mit einer Genauigkeit von 30 Mikrosekunden.
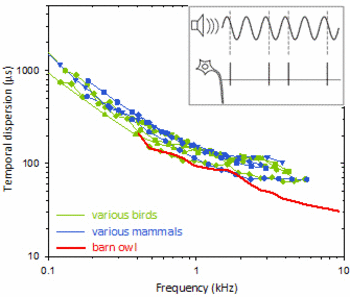
Streuung (Unschärfe) der zeitlichen Kodierung in Hörnervenzellen, in Abhängigkeit von der Schallfrequenz. Das kleine Einsatzbild zeigt schematisch wie die Messung erfolgt. Farbige Kurven zeigen die Medianwerte aus großen Stichproben von Einzelzellableitungen an mehreren Vogel- und Säugetierarten. Man beachte, dass die Zeitachse in Mikrosekunden skaliert ist – solch geringe Streuungen sind einmalig und charakteristisch für das Hörsystem! Der Rekordhalter unter den gezeigten Arten ist die Schleiereule, mit einer zeitlichen Unschärfe von unter 30µs.
Lust auf mehr? Hier gibt’s einen 15-minütigen Vortrag von Christine Köppl über das erstaunliche Innenohr der Schleiereule (auf englisch). Dieser Vortrag war Teil eines Symposiums zu Ehren von Prof. Masakazu (Mark) Konishi, am 17.2.2021
Was haben Bandsynapsen damit zu tun?
Wie einzelne Nervenzellen diese außergewöhnliche Präzision erreichen, ist immer noch weitgehend rätselhaft. Ein heißer Kandidat ist die chemische Synapse zwischen den Sinneszellen (Haarzellen) im Innenohr und den Neuronen des Hörnervs – die sog. Bandsynapse. Was genau ihr Beitrag zur zeitlichen Kodierung ist, ist Gegenstand aktiver Forschung. Wir vergleichen hierfür Details der Bandsynapsen von der Schleiereule, dem höchst spezialisierten Tier, mit solchen vom Huhn, einem nahen Verwandten mit durchschnittlichen Fähigkeiten bei der zeitlichen Kodierung. Zusätzlich entwickeln wir einen elektrophysiologischen Schnelltest, der wichtige Aspekte der zeitlichen Kodierung bei Vögeln quantifizieren kann. Dies ist Voraussetzung, um künftig verschiedenen Arten oder auch Tiere mit gezielt manipulierten Innenohren zu vergleichen.
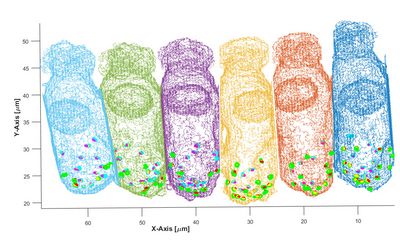
Hochvergrößernde, mikroskopische Aufnahme einiger, weniger Sinneszellen (Haarzellen) von der Schleiereule. Die Animation fokussiert durch die verschiedenen Schärfeebenen. Etwa 6 Haarzellen sind als graue Strukturen erkennbar. An ihrem unteren Ende sitzen die Bandsynapsen, hier mit einem Antikörper gegen ein präsynaptisches Protein markiert und als kleine rote Punkte sichtbar. Die hellblauen Strukturen sind Nervenfasern, die auf die Haarzellen zulaufen und sie mit vergrößerten Endköpfchen kontaktieren.
Was genau passiert bei Altersschwerhörigkeit in der Cochlea?
[Gefördert durch das Exzellenzcluster „Hearing4all“]
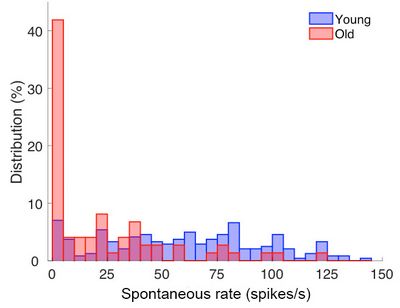
Säugetiere, und damit auch der Mensch, leiden mit zunehmendem Alter häufig an eingeschränktem Hörvermögen, das auf unvermeidliche Alterungsprozesse zurück geht. Traumatische Schädigungen durch z.B. extrem laute Musik oder Lärmbelastung im Beruf kommen noch hinzu und verschlimmern die Hörprobleme. Wir konzentrieren uns auf Alterungsprozesse im Innenohr (Cochlea). An alternden Wüstenrennmäusen quantifizieren wir den schleichenden Verlust von Synapsen und Nervenfasern, die die Information über alles Gehörte zum Gehirn übermitteln. Die verbleibenden Nervenfasern werden mit elektrophysiologischen Methoden untersucht, um zu klären, ob auch die genaue Kodierung auditorischer Information sich mit dem Alter verändert.
Vögel werden nicht schwerhörig im Alter
Es ist schon lange bekannt, dass Vögel nach Schädigung ihres Innenohrs neue Sinneszellen (Haarzellen) bilden können – eine Fähigkeit, die Säugetiere (und damit auch der Mensch) nicht besitzen. Wahrscheinlich wirken diese Reparaturmechanismen auch altersbedingten Degenerationsprozessen im Innenohr entgegen, denn Vögel werden nicht schwerhörig im Alter. Wir untersuchen die Innenohren von alten Vögeln (Hühnern und Schleiereulen), um zu klären, ob nicht nur die Haarzellen, sondern auch die mit ihnen verbundenen afferenten und efferenten Nervenfasern bis ins hohe Alter erhalten bleiben.
Evolution von Schallortung: Wie bestimmen Vögel den Ort einer Schallquelle?
Um ein Geräusch in der Umwelt zu orten, orientieren sich Tiere wie Menschen an winzigsten Unterschieden im zeitlichen Eintreffen und in der Lautstärke an den beiden Ohren: Liegt die Schallquelle seitlich, so trifft der Schall etwas früher und etwas lauter am zugewandten Ohr ein als am abgewandten. Diese sog. interauralen Unterschiede werden im Gehirn durch den Vergleich der Eingänge von beiden Ohren bestimmt und bilden die Grundlage für neuronale Karten des auditorischen Raums um ein Tier.
Seit Kurzem ist klar, dass nicht alle Tiere diese Berechnungen im Gehirn auf genau die gleiche Weise erreichen. Wir interessieren uns dafür, wie und warum die Evolution von Schallortungsmechanismen verschiedene Wege gegangen ist.
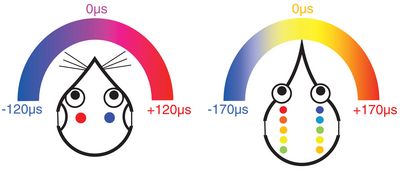
Unterschiede in der Art und Weise, wie Säugetiere (links) und Vögel (rechts) interaurale Zeitunterschiede (ITD) auf der Ebene des Hirnstamms repräsentieren. Beide Beispiele sind für typische Tiere mit viel kleineren Köpfen als der Mensch (z.B. Wüstenrennmaus und Huhn), die entsprechend auch nur relativ kleine ITDs erzeugen, hier 120 und 170 Mikrosekunden. Bei Säugetieren werden die Neurone auf jeder Hirnstammseite maximal erregt wenn die Schallquelle auf der gegenüber liegenden Seite des Tiers liegt. Die relative Erregung der Neurone beider Hirnhälften ist dann ein Indikator für die genaue Position der Quelle. Bei Vögeln sind die rezeptiven Felder der entsprechenden Neurone kleiner und ihre Aktivität ist ein direkter Indikator für die Position der Schallquelle.
Die neuronalen ITD Schaltkreise im Hirnstamm der Schleiereule als Mittel, um Feldpotentiale zu erklären
Forschung an der Schleiereule hat eine lange Tradition im Zusammenhang mit Schallortung im Allgemeinen und für das Verständnis wie interaurale Zeitunterschiede (ITD) im Gehirn bestimmt werden im Besonderen. Über kaum einen anderen neuronalen Schaltkreis, von den beteiligten Neuronen, über ihre Verbindungen bis zur zellulären Physiologie, weiß man mehr. Zusammen mit Kollegen in Berlin und Maryland (USA) machen wir uns dieses Wissen zunutze, um vorher zu sagen, wie die verschiedenen neuronalen Aktivitäten zusammen ein Feldpotential bilden. Feldpotentiale, wie z.B. das ABR (auditorisches Hirnstammpotential) oder EEGs, können auch am Menschen (d.h. nicht invasiv) gemessen werden und sind bedeutende Hilfsmittel in der klinischen Diagnostik. Je besser wir verstehen, wie Feldpotentiale entstehen und zusammen gesetzt sind, desto spezifischer können die Diagnosen sein.
Molekulare Steuerung der Entwicklung: Wie entsteht das komplexe Innenohr?
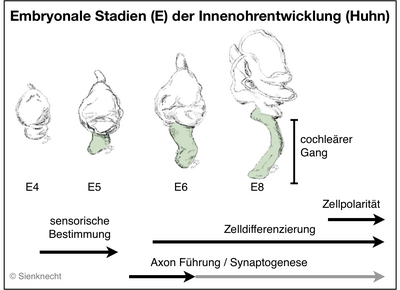
Das Innenohr der Wirbeltiere enthält eine ganze Reihe an sensorischen Organen (neben dem Hörorgan haben z.B. Vögel 7 und Säuger 5-6 Vestibular-Organe pro Ohr). Diese verschiedenen Sinnesorgane entwickeln sich aus einer gemeinsamen Ohranlage, der Otocyste, die regional spezifiziert wird und eine komplexe Morphogenese durchmacht (siehe Schema). Das dorsale Ohr bildet dabei das vestibuläre Labyrinthsystem mit den Gleichgewichtssinnesorganen, während der ventrale Abschnitt der Otocyste den cochleären Gang bildet, der das spezialisierte Hörepithel enthält.
Die Entwicklung des sensorischen Systems aus Mittelohr und Innenohr mit seiner funktionellen Differenzierung, sowie die neuronalen Projektionen der verschiedenen Innenohr-Sinnesorgane in die unterschiedlichen Hirnstamm-Kerngebiete (vergl. Abb. Anatomie der Innen- und Mittelohrregion) erfordert eine Vielzahl an essentiellen Entwicklungsprozessen.
Sie reichen beispielsweise von der Festlegung des Zellschicksals, der Zelldifferenzierung, der Axon-Führung und Synaptogenese bis hin zu Spezialisierungen von mechanosensorischen Zellen, besonders des auditorischen Epithels mit seinen individuell unterscheidbaren physiologischen und morphologischen Eigenschaften, oder dem Phänomen der planaren Zellpolarität (PCP).
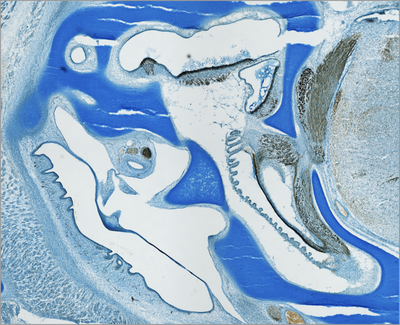
Anatomie der Innen- und Mittelohrregion (Histologischer Schnitt, Vogel):
Histologischer Schnitt durch die Innen- und Mittelohrregion eines Hühnchenembryos (Embryonaltag 11 von insgesamt 21). Das Innenohr entwickelt sich umschlossen von Knorpelgewebe, der sogenannten otischen Kapsel (Alcianblau-Färbung). Immunhistochemisch markierte Sinneszellen und Neurofilamente lassen die Sinnesepithelien der verschiedenen sensorischen Organe des Innenohrs und deren Verbindung mit dem Hirnstamm erkennen (braun).
Wie sind verschiedene Morphogene involviert?
Von den Entwicklungsprozessen selbst wissen wir inzwischen Vieles, deren molekulare Entwicklungssteuerung lässt dennoch viele Fragen offen. Obwohl dieses Forschungsfeld gegenwärtig schnell voran schreitet, ist unsere Vorstellung von dem molekularen Netzwerk, das diese Entwicklungsprozesse kontrolliert, weitgehend unvollständig.
Uns interessiert insbesondere die grundlegende Rolle verschiedener Signalmoleküle und ihre Signalwege. Dazu untersuchen wir räumlich-zeitliche Genaktivitätsmuster (Abb. Kartierung der Genexpression) und arbeiten daran, die Funktion von Schlüsselgenen zu identifizieren. Als methodischer Ansatz dient die experimentell induzierte Genmissexpression, deren Effekt wir analysieren.
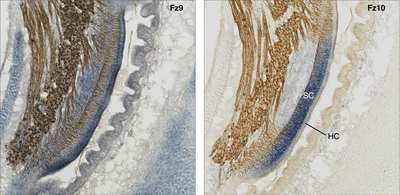
Kartierung der Genexpression:
Wnt Signalweg Genexpressionen im cochleären Gang (verglichen sind zwei benachbarte histologische Schnitte desselben Ohrs). Doppelfärbung des Gentranskripts (mRNA, blau) zweier verschiedener Frizzled Rezeptoren (Fz) mittels in-situ Hybridisierung und dem neurofilament-assoziierten Antigen (braun); Huhn, Embryonaltag 10. Man beachte das überlappende und doch teilweise exklusive Expressionsmuster der beiden Wnt-Rezeptoren. Fz10 ist beispielsweise in der Domäne der Stützzellen (SC) exprimiert, nicht jedoch in den Sinneszellen (Haarzellen, HC), während Fz9 hingegen von Haarzellen exprimiert wird.