Navigation
Baustein 1: Das Daltonsche Atommodell
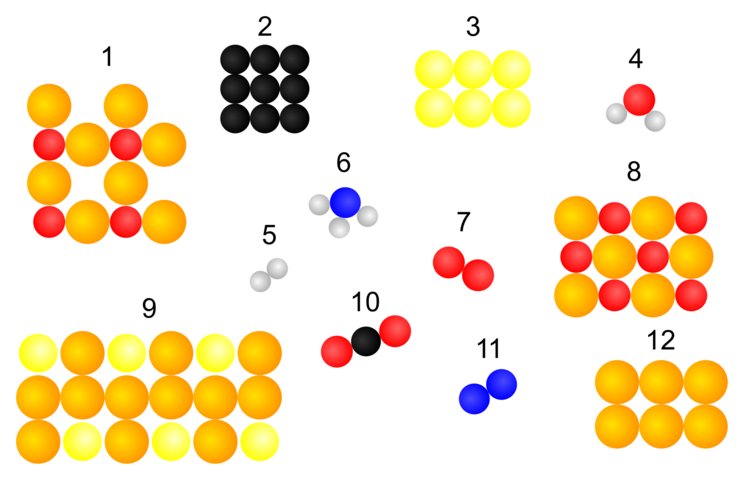
Heutige Darstellungsweise
Aufgabe
Hast du eine Vermutung um welche Elemente und Verbindungen es sich handeln könnte?
Wie hast du sie erkannt?
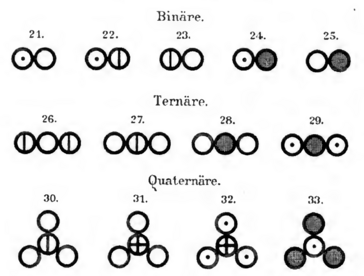
Historische Darstellungsweise
Die folgenden beiden Abbildungen zeigen dir Tabellen von John Dalton aus dem Jahr 1808. Er führte mit Hilfe dieser Abbildungen ein Modell ein, mit dem Elemente und Verbindungen dargestellt werden konnten.
Deshalb ist das Modell, auf dessen Grundlage die Darstellung der Elemente und Verbindungen am Anfang dieser Seite beruht, auch nach ihm benannt: Das Daltonsche Atommodell.
Aufgabe
- Vergleiche die Darstellung der Elemente und Verbindungen von Dalton mit denen am Anfang dieser Seite.
- Gibt es Gemeinsamkeiten in der Darstellungsweise?
- Erkennst du Unterschiede zwischen den Darstellungen?
- Was für Unterschiede kannst du erkennen?
Daltons Hypothesen
Dalton stellte Anfang des 19. Jahrhunderts, auf Grundlage seiner Untersuchungen der Eigenschaften von unterschiedlichen Gasen in seiner Arbeit „A New System of Chemical Philosophy“ die Hypothese auf, dass jeder Stoff aus kleinsten, nicht weiter teilbaren Teilchen, den Atomen, besteht. Darauf aufbauend machte er weitere Annahmen:
- Die Atome eines Elements sind gleich in ihrer Größe und Masse; Atome unterschiedlicher Elemente unterscheiden sich in ihrer Größe und Masse.
- Atome können nicht geteilt, erzeugt oder vernichtet werden.
- Bei einer chemischen Reaktion werden die Atome der Ausgangsstoffe neu angeordnet und in bestimmten Anzahlverhältnissen miteinander verbunden.
Auf Grundlage von Daltons Annahmen können verschiedene Phänomene schlüssig erklärt werden. Er war auch einer der ersten Wissenschaftler, der auf Grundlage experimenteller Ergebnisse eine Tabelle mit relativen Atommassen erstellte (siehe Zusatzmaterial). Das Gewicht eines Wasserstoffatoms setzte er dafür gleich 1. Die heutige atomare Masseneinheit unit (u) wurde daher früher auch als Dalton (Da) bezeichnet.
Aufgaben
Mithilfe des Daltonschen Atommodells können wir einige Phänomene chemischer Reaktionen erklären und diese auch nutzen.
Erläutere in eigenen Worten, mit Bezug zu Daltons Annahmen, die folgenden Beobachtungen und Möglichkeiten:
- Bei einer chemischen Reaktion bleibt die gesamte Masse der beteiligten Stoffe erhalten.
- Verbinden sich 2 oder mehr Elemente zu einer bestimmten Verbindung, dann geschieht dies immer in einem bestimmten, konstanten Massenverhältnis.
- Beispiel: 88,81 g Sauerstoff reagieren immer mit 11,19 g Wasserstoff zu 100 g Wasser.
- Es ist möglich zu berechnen, welche Masse Kohlenstoffdioxid entsteht, wenn 24 g Kohlenstoff vollständig mit Sauerstoff reagieren