Baustein 7.3: Das Schalenmodell der Atomhülle
Du hast in den letzten Abschnitten gelernt, dass sich die Elektronen in der Atomhülle in ihrem Energiegehalt unterscheiden und auf Energiestufen befinden. Diese Energiestufen sind fest definiert und jedes Element hat ganz bestimmte Energiestufen.
Es gibt also in der Atomhülle verschiedene, erlaubte Stufen für die Elektronen, doch es bleibt die Frage, wie wir uns diese Stufen vorstellen können und wie genau sich die Elektronen eines Atoms dort verteilen.
1913 hat der Physiker Niels Bohr ein Atommodell entwickelt, das heute als Bohr'sches Atommodell oder auch Schalenmodell bekannt ist.
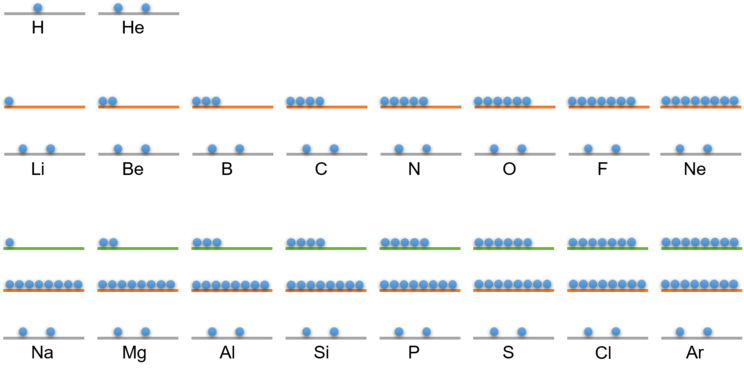
Er konnte die Verteilung der Elektronen auf den Energiestufen berechnen. Jede Energiestufe kann nur eine bestimmte maximale Anzahl an Elektronen aufnehmen. Die folgende Abbildung zeigt dir die von Bohr bestimmte Verteilung der Elektronen auf den ersten 3 Energiestufen. Darunter findest du auch noch eine Tabelle, welche dir die Verteilung zeigt. Wie sich die Elektronen auf höheren Energiestufen verteilen wird im Abschnitt für Interessierte weiter unten beantwortet.
Tabelle der Elektronenverteilung
Die folgende Tabelle zeigt dir die Verteilung der Elektronen auf den Energiestufen für die ersten 18 Elemente:
Elektronen auf Energiestufe 1 | Elektronen auf Energiestufe 2 | Elektronen auf Energiestufe 3 | |
1 H – Wasserstoff | 1 |
|
|
2 He – Helium | 2 |
|
|
3 Li – Lithium | 2 | 1 |
|
4 Be – Beryllium | 2 | 2 |
|
5 B – Bor | 2 | 3 |
|
6 C – Kohlenstoff | 2 | 4 |
|
7 N – Stickstoff | 2 | 5 |
|
8 O – Sauerstoff | 2 | 6 |
|
9 F – Fluor | 2 | 7 |
|
10 Ne – Neon | 2 | 8 |
|
11 Na – Natrium | 2 | 8 | 1 |
12 Mg – Magnesium | 2 | 8 | 2 |
13 Al – Aluminium | 2 | 8 | 3 |
14 Si – Silicium | 2 | 8 | 4 |
15 P – Phosphor | 2 | 8 | 5 |
16 S – Schwefel | 2 | 8 | 6 |
17 Cl – Chlor | 2 | 8 | 7 |
18 Ar – Argon | 2 | 8 | 8 |
Schalen als Energiestufen
Es bleibt aber weiter die Frage offen, wie wir uns diese Energiestufen vorstellen können. Auch diese Frage versuchte Bohr zu beantworten.
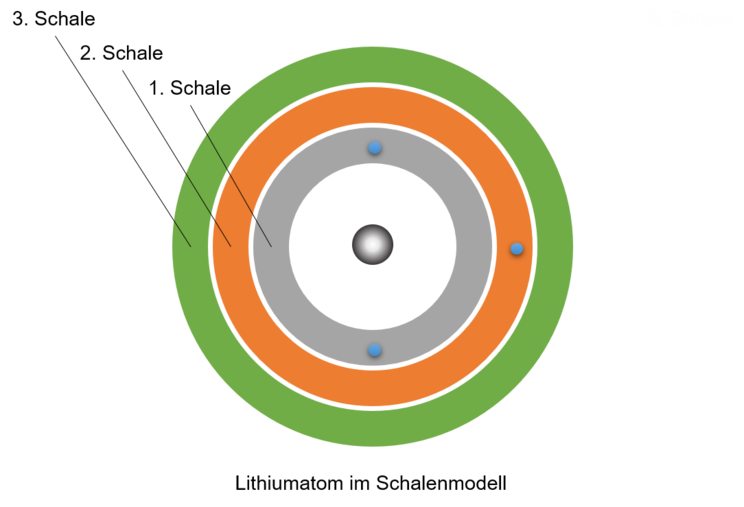
Schon das Atommodell von Dalton basierte auf der Vorstellung, dass Atome kugelförmig sind. Bohr konnte sogar berechnen, dass sich die Elektronen in einem festgelegten Abstand zum Atomkern befinden müssen. Er interpretierte dieses Ergebnis so, dass sich die Elektronen in sogenannten Schalen um den Atomkern befinden. Diese Erkenntnis lässt sich ohne Probleme mit dem Modell der Energiestufen verbinden. Die Schale, die sich am nächsten zum Atomkern befindet, entspricht der niedrigsten Energiestufe. In dieser Schale finden 2 Elektronen Platz. Die nächste Schale ist weiter vom Kern entfernt und kann bis zu 8 Elektronen aufnehmen, dies ist die zweite Energiestufe, usw.
Auf diese Weise können wir uns schrittweise ein zweidimensionales Modell eines Atoms aus einem Kern und einer Hülle aus Elektronen aufbauen. Die Elektronen befinden sich dabei in Schalen. Jede Schale ist eine Energiestufe.
Wir können uns das Atom in diesem Modell als eine Kugel vorstellen, die aus dem kleinen, aber schweren Atomkern und der Atomhülle aufgebaut ist. Die Atomhülle setzt sich dabei aus den Schalen zusammen. Sie befinden sich wie Schichten um den Atomkern und stellen die Bereiche dar, in denen sich die Elektronen befinden.
Aufgabe 7.3.1
- Ordne den Zeichnungen des Schalenmodells eines Atoms das richtige Element zu.
- Zeichne mithilfe der Tabelle zur Elektronenverteilung oder dem Bild der Elektronenverteilung auf den Energiestufen ein Schalenmodell eines Atoms der folgenden Elemente:
- Wasserstoff
- Kohlenstoff
- Sauerstoff
- Lithium
- Chlor
- Kalium *
*bei dieser Aufgabe musst du vielleicht ein bisschen nachdenken.
Erklärung der Flammenfärbung mit dem Schalenmodell
Aufgabe 7.3.2
Wir haben ausgehend von dem Problem wie die Linien der Emissionsspektren erklärt werden können, erarbeitet, wie die Hülle eines Atoms aufgebaut ist. Dieses Wissen sollst du jetzt verknüpfen.
- Fasse in eigenen Worten zusammen, wie die Entstehung der Emissionslinien mithilfe des Schalenmodells erklärt werden kann.
- Löse anschließend die digitale Aufgabe, indem du die Lücken im Text mit den passenden Begriffen füllst. So bekommst du eine Musterlösung für deine Zusammenfassung.
Aufgabe 7.3.3
Lithium-Verbindungen zeigen, wie auch elementares Lithium, eine rote Flammenfärbung. Die Linien des Emissionsspektrums kannst du dir in Baustein 7.1 nochmals ansehen. Du sollst nun die Entstehung einer dieser Emissionslinien eines Lithiumatoms mit Hilfe des Schalenmodells nachvollziehen.
- Löse die folgende Zuordnungsaufgabe, in der du den Begriffen die richtigen Zahlenwerte zuordnen sollst.
- Stelle zeichnerisch das Prinzip der Entstehung einer Emissionslinie bei der Flammenfärbung dar. Nutze dazu das Modell eines Lithiumatoms als Ausgangspunkt und teile den Prozess in sinnvolle Abschnitte auf.
Schau dir, wenn du Schwierigkeiten hast, einen Tipp nach dem anderen an.
Tipps
1. Tipp
Starte mit dem dargestellten Modell des Lithiumatoms.
Der Prozess besteht aus mehreren Teilschritten. Schau dir nochmal den Lückentext auf dieser Seite an.
2. Tipp
Die Teilschritte des Prozesses sind:
- Grundzustand
- Aufnahme von Energie
- angeregter Zustand
- Abgabe von Energie
- Grundzustand
3. Tipp
Zeichne für jeden Teilschritt zuerst den Atomkern und die 1. Schale, die mit 2 Elektronen besetzt ist.
Das 3. Elektron nimmt Energie auf und gibt sie wieder ab.
Erklärung der Ionisierungsenergien mit dem Schalenmodell
Aufgabe 7.3.4
Wir haben ausgehend von dem Phänomen der unterschiedlichen Ionisierungsenergien, erarbeitet, wie die Hülle eines Atoms aufgebaut ist. Dieses Wissen sollst du jetzt verknüpfen.
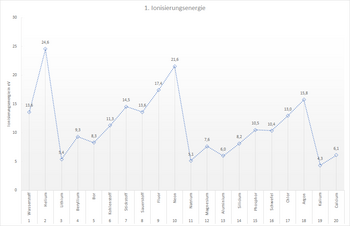
Als Unterstützung für die Lösung dieser Aufgabe ist unten noch mal das Diagramm aus Baustein 7.2 gezeigt. Du kannst auch die Schalenmodelle der jeweiligen Atome zeichnen. Vielleicht hilft dir das bei der Lösung.
- Begründe mithilfe des Schalenmodells der Elektronenhülle und der angegebenen Beispiele warum...
- ... die Ionisierungsenergie mit dem Beginn einer neuen Periode so stark abnimmt. Beispiel: Von Neon (21,6 eV) zu Natrium (5,1 eV).
- ... die Ionisierungsenergie innerhalb einer Hauptgruppe von oben nach unten abnimmt. Beispiel: Lithium (5,4 eV), Natrium (5,1 eV) und Kalium (4,3 eV).
- ... die Ionisierungsenergie innerhalb einer Periode von links nach rechts insgesamt steigt. Beispiel: Von Lithium (5,4 eV) zu Neon (21,6 eV).
Aufgabe 7.3.5
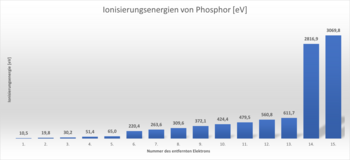
In Baustein 7.2 haben wir uns die Ionisierungsenergien für die Elektronen eines Phosphoratoms angeschaut. Du sollst jetzt dein Wissen über das Schalenmodell der Atomhülle nutzen, um diese zu erklären.
Als Unterstützung für die Lösung dieser Aufgabe ist unten noch mal das Diagramm aus Baustein 7.2 gezeigt. Du kannst auch das Schalenmodell eines Phosphoratoms zeichnen. Vielleicht hilft dir das bei der Lösung.
- Begründe mithilfe des Schalenmodells der Elektronenhülle den Verlauf dieser Ionisierungsenergien. Gehe dabei besonders auf die Energie ein, die benötigt wird, um das 5. und 6. sowie das 13. und 14. Elektron zu entfernen.
Die Edelgase
Oktettregel
Früher gab es sie noch häufiger, heute findet man sie kaum noch, aber vielleicht erinnerst du dich noch an Sie: Die Glühlampe mit einem Glühfaden. Das Bild rechts zeigt eine leuchtende Glühlampe.
Der Draht besteht aus Wolfram. Dieses reagiert aber mit dem Sauerstoff aus der Luft, vor allem wenn es heiß wird und glüht. Dadurch zerreißt der Glühfaden relativ schnell und die Lampe leuchtet nicht mehr. Bei der Entwicklung der Glühlampe versuchte man das zu verhindern, indem die Lampe luftleer gepumpt wurde. Aber auch diese Lampen brannten irgendwann durch, weil von außen noch Luft eindringen konnte.
Die Lösung waren die sogenannten Edelgase: Helium, Neon, Argon, Krypton und Xenon. Diese Elemente wurden gegen Ende des 19. Jahrhunderts entdeckt. Das besondere an diesen Elementen ist, dass sie nur sehr schwer, fast gar nicht, mit anderen Stoffen reagieren. Sie sind reaktionsträge bzw. "edel" und deshalb die ideale Füllung für die Glühlampen gewesen. Der Glühfaden brannte so nicht mehr durch, solange die Lampe dicht verschlossen war.
Aber warum sind die Edelgase so reaktionsträge?
Das kannst du dir mit Hilfe des Schalenmodells der Elektronenhülle erklären: Alle Edelgase haben eine voll besetzte äußere Elektronenschale. Jedes Heliumatom hat 2 Elektronen. Sie besetzen die erste Energiestufe bzw. die erste Elektronenschale, die damit voll ist. Neonatome haben 10 Elektronen, 2 auf der ersten Schale, 8 auf der zweiten Schale, die damit auch voll ist. Solche Atome, die ein voll besetzte äußere Elektronenschale haben, sind besonders stabil. Man nennt diese Regel: Oktettregel.
Wenn du den Baustein 7.2 bearbeitet hast, ist dir vielleicht schon etwas aufgefallen. Die Edelgase sind auch die Elemente mit den größten Ionisierungsenergien. Ein Grund dafür ist die Stabilität ihrer Elektronenhülle.
Für Interessierte zum Weiterdenken
Aufgabe 7.3.6
Du hast bisher die Verteilung der Elektronen auf den ersten 3 Energiestufen bzw. in den ersten 3 Schalen der Atomhülle kennengelernt.
Wie viele Elektronen müssten sich nach dem hier dargestellten Verteilungsprinzip auf der 4. Energiestufe bzw. in der 4. Schale der Atomhülle aufhalten?
Tipps
- Vergleiche die Zuordnung der Elektronen zu den Energiestufen mit der Position der Elemente im Periodensystem.
- Für jedes weitere Element, was du im Schalenmodell beschreiben möchtest, kommt ein Elektron im Modell hinzu.
Auflösung
Auf der Energiestufe 4 müssten sich, nach dem oben angegebenem Schema, 18 Elektronen für die Elemente Kalium bis Krypton (19 bis 36) aufhalten.
Doch damit hätten die Elemente von Gallium bis Krypton (31 bis 36) nicht die gleiche Anzahl an Elektronen auf ihrer äußersten Schale, wie ihre "oberen Nachbarn" in den Perioden 1 bis 3. Bohr erkannte darin einen Widerspruch, denn Experimente zum Verhalten der Elemente zeigten, dass dies der Fall sein musste.
Er löste dieses Problem, indem er Unterstufen einführte. Die Elektronen der Elemente 21 bis 30 befinden sich demnach auf einer eigenen Schale, auf der sich 10 Elektronen aufhalten können. Erst wenn diese Unterschale voll ist, wird die Energiestufe 4 weiter aufgefüllt. Dies soll an einem Beispiel verdeutlicht werden:
Das Element Arsen besitzt 33 Elektronen in der Hülle. Die ersten 18 Elektronen befinden sich auf den ersten drei Schalen, so wie ihr es aus dem Bild, der Tabelle und den Aufgaben kennt. Die Elektronen 19 und 20 befinden sich auf der Energiestufe 4. Das 21. Elektron wird auf einer Unterschale gebunden, auch das 22., 23. usw. bis die Unterschale mit 10 Elektronen gefüllt ist. Ab dem 31. Elektron wird dann wieder die Energiestufe 4 aufgefüllt, bis sich auf ihr insgesamt 5 Elektronen befinden, sodass sich auch bei dem Element Arsen 5 Elektronen auf der obersten Energiestufe befinden. Man könnte diese, von Bohr eingeführte, Unterstufe 4a nennen oder 4.1.
Du hast es geschafft, klasse!
Du bist am Ende der Einheit angekommen. In Baustein 2 findest du noch einen Abschnitt den du jetzt bearbeiten kannst. Du kannst außerdem auch noch das abschließende Quiz machen.