Material
Hier findest du das Material für diese Station.
-
 Tabelle: Kernladung und Atommasse Diese Tabelle beinhaltet die Elemente mit der Kernladung 1 bis 84 und ihre Atommasse.
Tabelle: Kernladung und Atommasse Diese Tabelle beinhaltet die Elemente mit der Kernladung 1 bis 84 und ihre Atommasse. -

Vertiefungsstation: Kernladung und Atommasse
In den beiden Stationen dieses Bausteins hast du mehr über den Kern eines Atoms und seinen Aufbau gelernt. Atomkerne sind aus Protonen und Neutronen aufgebaut. Die Anzahl der Protonen gibt die Kernladungszahl an, weil die Protonen einfach positiv geladen sind. Ein Neutron ist nicht geladen, hat aber die gleiche Masse wie ein Proton. Du hast auch gelernt, dass sich die Masse eines Atoms fast ausschließlich durch die Anzahl der Protonen und Neutronen bestimmt ist. Die Masse der Elektronen hat nur einen sehr geringen Anteil an der Gesamtmasse eines Atoms. Du hast im Modellexperiment auch selbst spüren können welche Rolle die Neutronen im Atomkern einnehmen: sie sorgen dafür, dass der Kern zusammenhält und nicht aufgrund der abstoßenden Kräfte zwischen den Protonen zerfällt.
Wir können uns jetzt fragen: Wie hängt die Anzahl der Protonen, also die Kernladungszahl, mit der Anzahl an Neutronen im Kern zusammen? Wie viele Neutronen „braucht“ ein Kern damit er stabil bleibt?
Um diesen Zusammenhang analysieren zu können, kannst du die Kernladungszahl und die Atommasse verwenden. Die Kernladungszahl ist die Anzahl der Protonen im Atomkern und die Atommasse ist die Anzahl der Protonen + die Anzahl der Neutronen.
Aufgabe 6.3.1 - für Profis (optional)
Zeichne per Hand oder mithilfe von beispielsweise Excel ein Diagramm, dass den Zusammenhang zwischen Kernladung und Atommasse darstellt. Nutze verschiedene, mindestens 25 der Elemente. Die Daten dafür findest du unter Material auf der linken Seite. Zeichne auch die Gerade ein, die sich ergeben würde, wenn die Atommasse jedes Elements doppelt so groß wie seine Kernladungszahl wäre.
Die folgende Tabelle kann als Anhaltspunkt für dich dienen:
| Element | Kernladung | Atommasse (u) |
|---|---|---|
| Wasserstoff | 1 | 1,0079 |
| Helium | 2 | 4,0026 |
| Lithium | 3 | 6,9675 |
| Beryllium | 4 | 9,0122 |
| Bor | 5 | 10,813 |
| Kohlenstoff | 6 | 12,011 |
| ... |
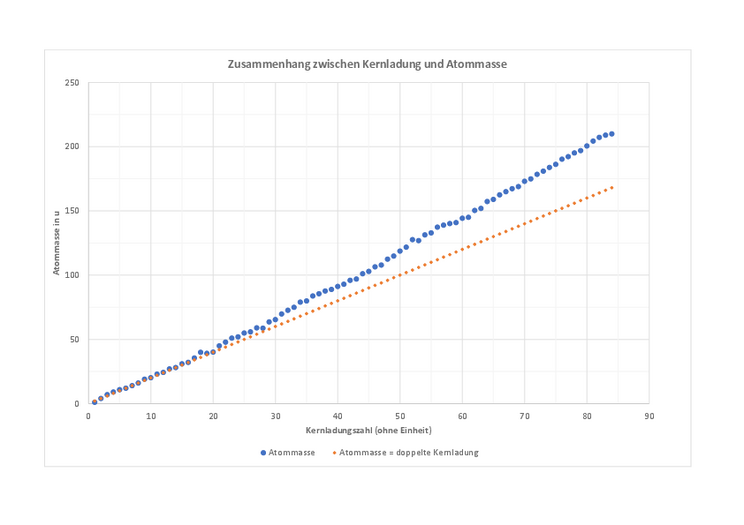
Der Zusammenhang zwischen Kernladung und Atommasse
In diesem Diagramm ist der Zusammenhang zwischen der Kernladung und der Atommasse aller Element bis zur Kernladungszahl 84 dargestellt. Außerdem ist auch die Gerade eingezeichnet, die sich ergeben würde, wenn die Atommasse jedes Elements doppelt so groß wie seine Kernladungszahl wäre. Wenn du die optionale Aufgabe gemacht hast, könnte dein Diagramm ungefähr so aussehen, nur mit weniger Punkten.
Aufgabe 6.3.2
- Formuliere schriftlich eine Beschreibung des Diagramms.
- Tipp: Das Arbeitsblatt "Strategie zur Beschreibung eines Diagramms" kann dir dabei helfen.
- Achte darauf, dass du nur beschreibst und nicht auswertest.
- Wenn du mit deiner Beschreibung fertig bist, bearbeite die digitale Aufgabe. Löst du diese richtig, hast du eine Musterlösung für die Diagrammbeschreibung. Überprüfe damit deine eigene Beschreibung und korrigiere sie, wenn nötig.
Aufgabe 6.3.3: Die Auswertung des Diagramms
Nachdem du jetzt das Diagramm beschrieben hast, musst du es noch auswerten. Zum Beginn dieser Station haben wir uns gefragt:
Wie hängt die Anzahl der Protonen, also die Kernladungszahl, mit der Anzahl an Neutronen im Kern zusammen? Wie viele Neutronen „braucht“ ein Kern damit er stabil bleibt?
Deute den im Diagramm dargestellten Zusammenhang zwischen Kernladung und Atommasse in Bezug auf diese Fragen. Nutze deine Diagrammbeschreibung und die Zusammenfassung vom Beginn dieser Station. Formuliere zunächst deine Deutung, dann kannst du dir die Musterlösung anschauen und mit deiner Deutung vergleichen.
Lösungsvorschlag Diagrammauswertung
Protonen und Neutronen haben ziemlich genau die gleiche Masse, aber nur die Protonen bestimmen die Kernladung. Atommasse minus Kernladungszahl ergibt in etwa die Neutronenzahl.
Das heißt, dass die orange Datenreihe angibt, wie groß die Atommasse der Elemente wäre, wenn die Anzahl der Neutronen immer genauso groß wie die Anzahl der Protonen wäre. Im Diagramm ist zu erkennen, dass dieser Zusammenhang nur bei den leichten Elementen mit kleiner Protonenzahl zutrifft. Je größer die Kernladungszahl wird, also die Anzahl der Protonen im Kern, desto mehr weicht die Atommasse von der orangen Datenreihe ab. Es werden also mehr Neutronen als Protonen „nötig“, damit der Atomkern der schweren Elemente stabil bleibt.