Arbeitsblätter
Hier findest du die Arbeitsblätter für diesen Baustein.
Arbeitsblatt Flammenfärbung
-
 Arbeitsblatt Flammenfärbung Auf diesem Arbeitsblatt findest du die Anleitung für das Experiment Flammenfärbung.
Arbeitsblatt Flammenfärbung Auf diesem Arbeitsblatt findest du die Anleitung für das Experiment Flammenfärbung.
Baustein 7.1: Die Flammenfärbung
Licht und Farbe
Sicher hast du schon mal eine CD oder DVD in der Hand gehabt, aber hast du sie dir schon mal ganz genau angeschaut?
Aufgabe 7.1.1
Nimm dir eine CD oder DVD und halte die Unterseite in das Licht, drehe und wende sie.
Beschreibe deine Beobachtungen.
Rückseite einer DVD im Sonnenlicht
Du kannst an dieser DVD ein Naturphänomen wahrnehmen, welches dem Regenbogen ähnlich ist. An einer CD oder DVD wird das Licht durch Beugung an der speziellen Oberfläche in seine Farben zerlegt. Bei einem Regenbogen geschieht das durch Lichtbrechung in Regentropfen.
DVD-Oberfläche und Lichtbrechung im Regentropfen
Dieses Bild zeigt die Oberfläche einer DVD. Diese ist aus vielen kleinen aufeinanderfolgenden Furchen aufgebaut ist. Das Bild wurde mit einem Rasterkraftmikroskop aufgenommen.

Dieses Bild zeigt, wie weißes Sonnenlicht in einem Regentropfen gebrochen wird, sodass man alle Spektralfarben in einem Regenbogen sehen kann.
Diese Phänomene zeigen uns vor allem eines: Das Sonnenlicht, wie wir es kennen, ist nicht einfach „nur weißes Licht“, sondern setzt sich aus allen Farben des Farbspektrums zusammen. Wir können Licht physikalisch-mathematisch als Welle charakterisieren und die Farben, die wir wahrnehmen, über ihre jeweilige Wellenlänge beschreiben. Der sichtbare Bereich des Lichtes reicht vom violetten Licht mit einer Wellenlänge von etwa 400 nm bis hin zum roten Licht, das eine Wellenlänge von bis zu 750 nm hat. Unterhalb von 400 nm liegt der Bereich des ultravioletten Lichtes (UV-Strahlung), oberhalb von etwa 750 nm liegt der Bereich des infraroten Lichtes.
Es gibt aber auch Lichtquellen, die kein weißes Licht ausstrahlen. Du kennst sicher Beispiele, etwa Leuchtröhren, wie die Neonröhre, oder Feuerwerk, das in vielen unterschiedlichen Farben leuchten kann.
Aufgabe 7.1.2
Wie können wir untersuchen, ob das Licht von solchen Lichtquellen auch aus unterschiedlichen Farben zusammengesetzt ist?
Führe dafür das Experiment: Flammenfärbung durch. Wenn ihr das Experiment nicht in der Schule durchführen könnt, sieh dir alternativ das Video zu dem Experiment an.
Bearbeite anschließend die folgenden Aufgaben:
- Beschreibe deine Beobachtungen, wenn du die Flamme ohne und mit Handspektroskop betrachtest.
- Stelle eine begründete Vermutung auf, durch welches Element der verschiedenen Salze die unterschiedlichen Färbungen der Flamme hervorgerufen werden.
- Beurteile, ob du diese Beobachtungen mit dem aktuellen Atommodell erklären kannst.
Video: Experiment zur Flammenfärbung
Das Experiment Flammenfärbung zeigt dir ein Phänomen, welches bereits für die Naturwissenschaftler im gesamten 19. Jahrhundert eine unerklärte Erscheinung war: Die Atome eines Elements geben, wenn sie angeregt werden, Licht in ganz bestimmten Wellenlängen ab. Auch wenn wir nur eine bestimmte Farbe sehen, diese Farbe ist eine Mischung unterschiedlichen Lichtes mit ganz bestimmten Wellenlängen.
Die Anregung der Atome geschieht durch Zufuhr von Energie. Bei der Flammenfärbung passiert das durch die Wärmeenergie des Gasbrenners. Bei Feuerwerkskörpern wird das Leuchten auch durch Wärmeenergie ausgelöst, in Leuchtröhren durch elektrische Energie. Durch das Handspektroskop sind die sogenannten Emissionsspektren der Elemente sichtbar. Die folgenden Abbildungen zeigen dir nochmals die Emissionsspektren einiger Elemente (Quelle der Spektren: Nino Čutić (2007)).
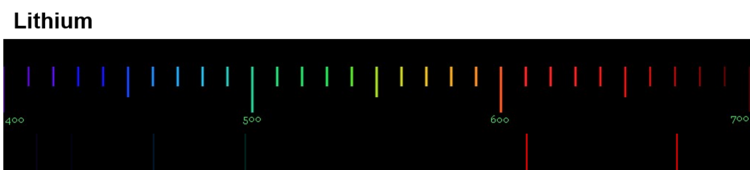
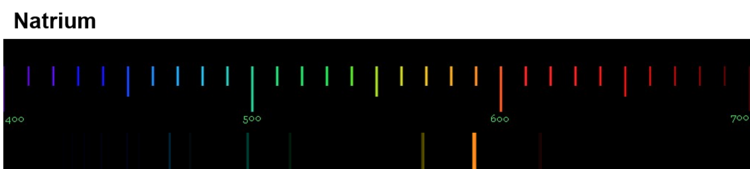
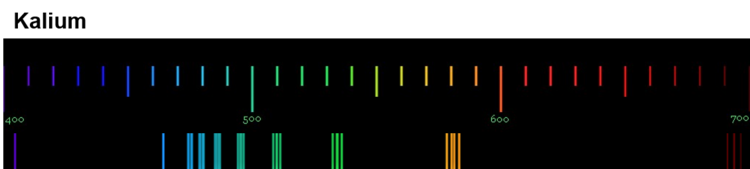
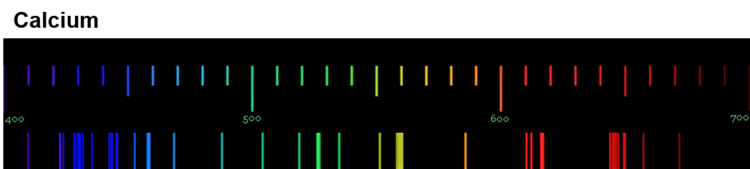
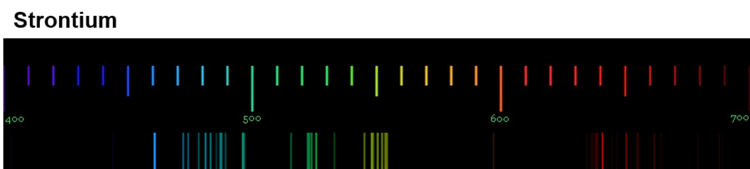
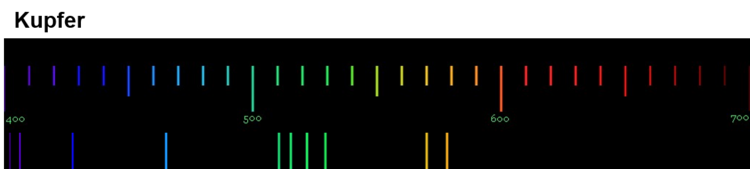

Diese Spektren sind etwas ganz Besonderes. Die Linien, die ein Element im Emissionsspektrum zeigt, sind immer gleich und zwei Elemente haben niemals das gleiche Spektrum.
Wenn diese Spektren also für jedes Element einzigartig sind, bedeutet das: Die Ursache dieses Phänomens muss im Aufbau der Atome des Elements liegen! Alle Atome eines Elements müssen eine Gemeinsamkeit haben, die sie von den Atomen anderer Elemente unterscheidet.
Um die Entstehung der Emissionsspektren erklären zu können, musst du noch etwas mehr über Licht und Energie erfahren:
Albert Einstein konnte im Jahr 1905 zeigen, dass die Energie des Lichtes abhängig von seiner Wellenlänge ist. Außerdem kann diese Energie auch nur in definierten „Portionen“, sogenannten Energiequanten, aufgenommen und abgegeben werden. Das bedeutet: Das Licht, welches die Elemente aussenden, hat genau die Energie, die vorher durch das Atom aufgenommen wurde.
Für die Erklärung der einzigartigen Emissionsspektren ist das sehr wichtig: Jede Linie eines Spektrums steht für eine ganz bestimmte Energie. Und weil jedes Element ein einzigartiges Spektrum hat, bedeutet das: Jedes Atom eines bestimmten Elements kann auch nur ganz bestimmte Energiebeträge aufnehmen und abgeben.
Wir können also sagen: Die Atome eines Elements haben Energiestufen.
Wir wissen aber noch nicht wie diese Aufnahme und Abgabe von Energie abläuft. Das sollst du jetzt erfahren.
Elektronen können Energie aufnehmen und abgeben
Bisher stellen wir uns das Atom als Kugel vor. Wir wissen auch, dass die kleinen, leichten Elektronen, die Träger negativer Ladung, ein Baustein der Atome sind.
Wie sich die Elektronen verteilen wissen wir nicht, aber sie sind im Atom nicht fest gebunden. Das konntest du schon in Baustein 3 erfahren, als du, nur durch Reibung Dinge aufladen konntest. Einstein fand heraus, dass die Elektronen in den Atomen Energie aufnehmen und abgeben können und so zwischen den sogenannten Energiestufen "hin und her springen".
Nun stellt sich die Frage: Wie können wir uns diese Energiestufen vorstellen und wie verteilen sich die Elektronen eigentlich?
Die Antwort auf diese Frage findest du in Baustein 7.3.
Für Interessierte
Von besonderem Interesse für die Wissenschaftler war das Emissionsspektrum von Wasserstoff, da es das Element ist, dessen Atome den einfachsten Aufbau haben. Sie hofften daher, dass sie die Ursache und die Gesetze der Lichtemission anhand des Wasserstoffspektrums erklären könnten. Das Emissionsspektrum von Wasserstoff kann mithilfe einer Leuchtröhre, die mit Wasserstoffgas gefüllt ist, erzeugt werden. Das Spektrum von Wasserstoff besteht aus 4 Linien im sichtbaren Bereich. Ihre Wellenlängen sind von links nach rechts: 410, 434, 486 und 656 nm.
Die folgende Abbildung zeigt dir das Emissionsspektrum von Wasserstoff.
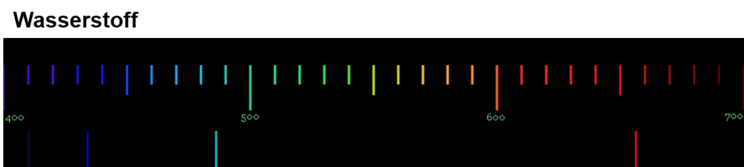
Experimentelle Aufnahme von Emissionsspektren
Die folgenden Bilder zeigen beispielhaft einen Versuchsaufbau zur Aufnahme des Emissionsspektrums von Wasserstoff und das endgültige Ergebnis. Dafür wurde eine Wasserstofflampe, ein optischer Spalt, ein optisches Gitter sowie ein einfacher Schirm mit gebleichtem Papier verwendet. Beachte, dass aufgrund der Versuchsanordnung das langwelligere rote Licht links auf dem Schirm erscheint und nicht, wie oben, rechts. Außerdem sind die Abstände der Linien nicht, wie oben, maßstabsgetreu auf einer Skala anzuordnen.
Zur Aufnahme des Spektrums empfiehlt es sich den Raum komplett abzudunkeln und eine Kamera mit automatischer Einstellung der Belichtungszeit zu verwenden. Moderne Smartphones eignen sich dafür auch.
Das Max-Planck-Institut für Plasmaphysik stellt auf seiner Seite eine Bauanleitung für ein Handyspektrometer zur Verfügung.
Berechnung der Energie von Licht
Einstein konnte eine Formel herleiten, die den Zusammenhang zwischen Wellenlänge und Energie beschreibt. Für diese Arbeit erhielt er 1921 den Nobelpreis für Physik. Die Formel siehst du hier:
\(E= \frac{\left(h\cdot c\right)}{\lambda}\)
mit der Planck-Konstante h = 6,626 • 10-34 J • s
der Lichtgeschwindigkeit im Vakuum c = 299.792.458 \({m \over s}\)
und der Wellenlänge λ in Metern
Mit dieser Formel können wir also die Energie berechnen, die das Licht einer bestimmten Linie eines Emissionsspektrums definiert ist.
Für die 4 Linien des Wasserstoffspektrums ergeben sich die folgenden Energiebeträge:
Wellenlänge [nm] | Energie des Lichts [eV] |
656 | 1,89 |
486 | 2,55 |
434 | 2,86 |
410 | 3,02 |
Hinweis: Die Einheit Elektronvolt [eV] ist die „handliche“ Einheit der Energie, wenn es darum geht sehr kleine Energiebeträge anzugeben. 1 eV entspricht 1,602 · 10-19 J • s
Senden Wasserstoffatome rotes Licht mit der Wellenlänge 656 nm aus, so geben sie eine Energiemenge von 1,89 eV ab. Senden sie blaues Licht mit der Wellenlänge 434 nm aus, geben sie 2,86 eV Energie ab. Diese Energie müssen die Atome vorher aufgenommen haben.










