Station 1: Weitere Bausteine der Atome
Rutherford entdeckt einen weiteren Baustein des Atoms
Im Jahr 1919 forschte Ernest Rutherford an der Wechselwirkung von α-Teilchen mit verschiedenen Stoffen. α-Teilchen sind die Teilchen, aus denen die radioaktive α-Strahlung besteht (siehe Baustein 4).
Bei einem Experiment beschoss er gasförmigen Stickstoff mit α-Teilchen und konnte dabei mithilfe eines speziellen Schirms, beobachten, dass ein einfach positiv geladenes Teilchen entsteht.
Rutherford vermutete, dass diese Teilchen durch die α-Teilchen aus den Stickstoffatomen herausgeschlagen werden. Er hatte mit diesen Experimenten einen Baustein der Atome gefunden.
Er nannte dieses Teilchen, mit der Masse 1 u und einfacher positiver Ladung, Proton (aus dem altgriechischen ‚das erste‘).
Die Protonen sind, neben den Elektronen, ein weiterer Baustein eines Atoms. Da sie positiv geladen sind, sorgen sie dafür, dass ein Atom insgesamt elektrisch neutral ist. Ein neutrales Atom ist also aus genau so vielen Protonen wie Elektronen aufgebaut.
Heute wissen wir, dass ein Atom aus einem Kern und einer Hülle besteht und dass die Protonen sich im Atomkern befinden. Die Elektronen sind in der Hülle des Atoms verteilt. Da die Protonen im Kern, verglichen mit den Elektronen in der Hülle, viel schwerer sind, ist der Großteil der Masse eines Atoms im Kern konzentriert. Aber wie kommt es, dass sich die Protonen im Kern nicht gegenseitig abstoßen? Sie tragen alle eine positive Ladung und gleiche Ladungen stoßen sich ab.
Ein Modellversuch zum Aufbau des Atomkerns
Aufgabe 6.1.1
Lege einige identische Ringmagnete mit dem gleichen Pol nach oben auf eine feste Unterlage. Versuche nun die Magnete möglichst nah aneinander zu bringen, ohne sie noch festzuhalten oder übereinander zu legen.
- Beschreibe und notiere deine Beobachtungen.
Lege jetzt Cent-Münzen auf die Unterlage zwischen die Magnete und prüfe, wie nah du sie nun aneinander bringen kannst.
- Beschreibe und notiere deine Beobachtungen.
- Deute den Unterschied zwischen den beiden Versuchen. Erkläre dabei die Rolle der Cent-Münzen in diesem Modellversuch.
Solltest du den Versuch nicht selber durchführen können, schaue dir einfach das folgende Video an und bearbeite die Aufgaben.
Ein weiterer Kernbaustein
In dem Modellversuch konntest du anhand der Magneten, die hier ein Modell für die Protonen sind, selbst spüren, dass sich gleiche Ladungen abstoßen. Legen wir aber Münzen zwischen die „Protonen“ können wir einen „Kern“ bauen, der zusammenhält.
Den Beweis, dass es solche Teilchen im Atomkern gibt, die wie die Münzen im Modellexperiment wirken, konnte erst 1932 James Chadwick, ein Mitarbeiter Rutherfords, liefern.
Er entdeckte, dass der Atomkern nicht nur aus Protonen aufgebaut ist. Ein weiterer Baustein des Kerns sind die Neutronen. Im Modellversuch hast du bereits gesehen, welche Rolle die Neutronen für den Aufbau des Atomkerns spielen. Sie sorgen dafür, dass die Protonen dicht beieinanderbleiben können und der Atomkern stabil bleibt. Neutronen tragen keine Ladung (daher auch der Name) und sind etwa genauso schwer wie Protonen. Beide haben die Masse 1 u.
Protonen und Neutronen machen zusammen fast die gesamte Masse des Atoms aus. Die Masse eines Atoms ergibt sich aus der Summe der Protonen und Neutronen. Die sehr leichten Elektronen haben fast keinen Einfluss auf die Masse eines Atoms.
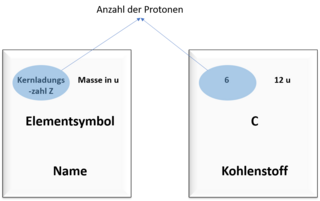
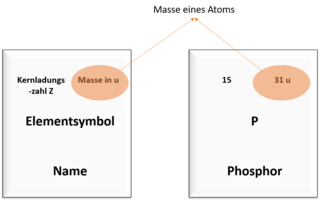
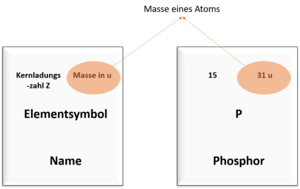
Protonenzahl und Masse im Periodensystem
Das Periodensystem kennst du bestimmt aus dem Unterricht. Dort sind viele Informationen über die Elemente zusammengefasst.
Unter anderem kannst du im Periodensystem auch die Anzahl der Protonen eines Atoms und die Masse des Atoms ablesen. Die Bilder zeigen dir, wo du welchen Wert finden kannst.
Übung
Aufgabe 6.1.2
Die Anzahl der Neutronen eines Atoms ergibt sich also aus der Massenzahl des Atoms minus der Zahl der Protonen des Atoms.
Ein Beispiel:
Ein Atom des Elements Phosphor hat die Massenzahl 31 und die Kernladungszahl 15.
Die Anzahl der Neutronen ist also: 31 - 15 = 16
Überprüfe das Gelernte in der folgenden Übungsaufgabe.
Aufgabe 6.1.3
Fasse die Informationen dieser Station zusammen, indem du folgende Fragen beantwortest:
- Nenne die Teilchen, aus denen der Atomkern aufgebaut ist.
- Beschreibe die Rolle, der einzelnen Bausteine des Atomkerns und nenne ihre Eigenschaften.
- Beschreibe, wie sich die Masse eines Atoms zusammensetzt. Beurteile dabei auch den Einfluss der Elektronen.
Wie stellst du dir einen Atomkern vor? Entwickle ein Gedankenmodell und zeichne einen Kohlenstoffatomkern mit 6 Neutronen.
Tipp: Kohlenstoff hat die Kernladungszahl 6.