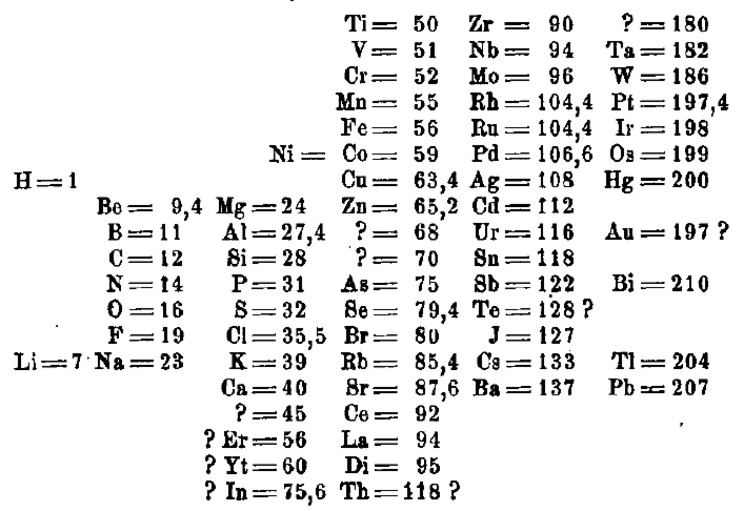Material
Hier findest du das Material für diesen Baustein.
Elementkarten
-
 Elementkarten 237 KB
Elementkarten 237 KB -
Elementkarten Archiv 478 KB
Baustein 2: Die Ordnung der Elemente
Sicher erinnerst du dich an John Dalton. Er war 1808 einer der ersten Wissenschaftler, der einen Versuch unternahm, die damals bekannten Elemente in eine Ordnung zu bringen. Als Ausgangspunkt nutzte er die damals bekannte Atommasse. Die folgende Tabelle stammt aus einer Übersetzung seiner Arbeit „A New System of Chemical Philosophy“. So ordnete Dalton vor über 200 Jahren die Elemente.
Du hast schon einiges über die Elemente gelernt und dir ist sicher auch aufgefallen, dass Dalton einige "Elemente" in seiner Ordnung hat, die es heute nicht gibt. Das liegt daran, dass sich die Namen geändert haben oder festgestellt wurde, dass es sich eigentlich um Verbindungen handelt.
Wenn du die Atommassen der Elemente mit den genauen Werten vergleichst, zeigen sich auch hier deutliche Unterschiede. Doch Dalton machte damals mit dieser Aufstellung den Anfang für ein Ordnungssystem der Elemente.
Zu Beginn des 19. Jahrhunderts waren etwa 28 Elemente bekannt, im Laufe des 19. Jahrhunderts wurden viele weitere Elemente entdeckt, ihre Atommassen bestimmt und weitere Eigenschaften charakterisiert, sodass ihre Anzahl am Ende des Jahrhunderts auf 84 angewachsen war. Die Zahl hatte sich also verdreifacht.
Die immer länger werdende Liste der Elemente in dieser Zeitspanne führte dazu, dass verschiedene Wissenschaftler Versuche unternahmen und unterschiedliche Systeme zur Anordnung der Elemente entwickelten, um ein sinnvolles und übersichtliches Ordnungssystem zu schaffen.
Aufgabe 2.1
Übernimm die Rolle eines Naturwissenschaftlers.
Entwickle mithilfe der 34 Elementkarten ein sinnvolles und übersichtliches Ordnungssystem für die Elemente. Ermittle dazu Gemeinsamkeiten, Unterschiede und Trends in den Eigenschaften der Elemente.
Solltest du nicht weiterkommen, können dir die Tipps weiter unten vielleicht helfen.
Tipps
1. Tipp
Dalton ordnete die Elemente zunächst nach ihrer Atommasse. Vielleicht beginnst auch du damit.
2. Tipp
Betrachte die verschiedenen Informationen auf den Elementkarten und suche nach einer Möglichkeit die Elemente weiter zu ordnen.
Wähle zunächst immer nur eine Information als Grundlage.
3. Tipp
Betrachte die wichtigen Verbindungen der Elemente, vergleiche Sie und finde Gemeinsamkeiten.
4. Tipp
Ordne die Elemente, die ähnliche wichtige Verbindungen haben, nebeneinander oder untereinander an.
Aufgabe 2.2
Wenn du mit deinem Ordnungssystem der Elemente zufrieden bist, lies den Abschnitt "Historische Entwicklung eines Ordnungssystems" und vergleiche das von dir entwickelte Ordnungssystem mit den historischen Varianten, die du in diesem Abschnitt findest.
Vergleichspunkte könnten sein:
- Die Atommassen der Elemente
- Elemente
- Anzahl der Elemente
- Gibt es Elemente, die nur bei dir oder nur bei den historischen Varianten auftauchen?
- Ordnungsprinzip
- Wo findest du die Elemente mit ähnlichen wichtigen Verbindungen
Historische Entwicklung eines Ordnungssystems
Im einleitenden Text wurde bereits erwähnt, dass im Laufe des 19. Jahrhunderts eine Vielzahl von chemischen Elementen entdeckt wurde. Die folgende Übersicht lässt erahnen, wie schnell die Anzahl an Elementen stieg.
| bis zum Jahre 1700 | 13 Elemente |
| am Ende des 18. Jahrhunderts | 28 Elemente |
| bis zum Jahre 1850 | 59 Elemente |
| am Ende des 19. Jahrhunderts | 84 Elemente |
Die Entwicklung eines Ordnungssystems der Elemente schien aufgrund der Vielzahl an Elementen notwendig, um eine systemische Übersicht nutzen zu können. Die immer genauer werdenden Atommassen und die bekannten chemischen Ähnlichkeiten einiger Elemente boten Ansatzpunkte zur Erstellung einer solchen Übersicht.
Besonders zwei Chemiker ragten in der 2. Hälfte des 19. Jahrhunderts heraus: Der Deutsche Julius Lothar Meyer und der Russe Dimitrij Iwanowitsch Mendelejew. Sie erarbeiteten unabhängig voneinander ein Ordnungssystem der Elemente, welches auf chemisch ähnlichem Verhalten, ansteigenden Atommassen und periodischen Gesetzmäßigkeiten derselben beruhte. Mendelejew ging dabei ähnlich vor wie ihr es getan habt. Er berichtete etwa:
"Da begann ich nun, nachdem ich auf getrennten Kärtchen die Elemente mit ihren Atomgewichten und Grundeigenschaften aufgeschrieben hatte, die ähnlichen Elemente und nahe beieinander liegenden Atomgewichte zu sammeln – dies führte mich schnell zu der Schlussfolgerung, dass die Eigenschaften der Elemente in einer periodischen Abhängigkeit von ihrem Atomgewicht stehen." (Walden, 1965)
Er veröffentlichte 1869 seine erste Version des Periodensystems. Daraufhin, im Jahre 1870, veröffentlichte auch Meyer sein eigenes System, welches er 1868 entworfen hatte. Beide Wissenschaftler prägten also ihre Arbeit gegenseitig, denn Mendelejew überarbeitete daraufhin sein System und veröffentlichte 1871 eine neue Version seines Periodensystems der Elemente.
Mendelejew ließ in seinem System aber auch Lücken. Diese Lücken ließen Platz für noch zu entdeckende Elemente, deren Eigenschaften (Atommasse, Dichte, chemisches Verhalten, u.a.) er mithilfe seines Systems vorhersagte.
Im Laufe der nächsten 15 Jahre wurden diese drei Elemente: Scandium, Gallium und Germanium tatsächlich entdeckt. Gallium und Germanium hast du in deinem System auch bereits eingeordnet. Die von Mendelejew gemachten Vorhersagen zu ihren Eigenschaften waren nahezu perfekt. Das war seine größte Leistung im Hinblick auf die periodischen Eigenschaften der Elemente.
Die folgenden Abbildungen zeigen dir die Ordnungssysteme von Mendelejew und Meyer.
Die Edelgase
Du hast bei dem Vergleich deines eigenen Ordnungssystems mit denen von Mendelejew und Meyer sicher festgestellt, dass du eine ganze Gruppe von Elementen mit in dein System aufgenommen hast, welche die beiden Wissenschaftler nicht in ihr System integriert haben: die Edelgase (Helium, Neon, Argon, Krypton, Xenon (und Radon)).
Diese Gase wurden in den Jahren 1868 bis 1900 entdeckt und als Elemente erkannt.
Sie fügten sich als ganz neue Gruppe perfekt in das von Mendelejew und Meyer aufgestellte Ordnungssystem ein. Spätestens ab diesem Zeitpunkt war das Periodensystem als Modell zur Ordnung der Elemente in den Naturwissenschaften anerkannt.
Das Periodensystem heute
Heute (Stand 2015) umfasst das Periodensystem 118 Elemente in 18 vertikalen Gruppen und 7 horizontalen Perioden. Die Systematik und Vorhersagekraft, die Mendelejew und Meyer 146 Jahre vorher entwickelten, bleibt bis heute bestehen.
Die folgende Abbildung zeigt das aktuelle Periodensystem der Elemente:
Wenn du bereits bis Baustein 7.3 gearbeitet hast...
Ordnungszahl und Kernladungszahl
Die Reihenfolge der Elemente im Periodensystem wird durch die Ordnungszahl beschrieben. Die Ordnungszahl, auch Kernladungszahl genannt, gibt die Anzahl der Protonen in einem Atomkern an. Da in jedem ungeladenen Atom die Zahl der Protonen im Kern mit der Zahl der Elektronen in der Atomhülle übereinstimmt, gibt die Ordnungszahl indirekt auch die Elektronenzahl in einem Atom an. Beispielsweise hat das Element Wasserstoff die Ordnungszahl 1. Der Wasserstoff-Atomkern besteht daher aus nur einem Proton; in seiner Atomhülle befindet sich ein Elektron. Auf Wasserstoff folgt im Periodensystem Helium mit der Ordnungszahl 2. Ein Helium-Atom hat daher zwei Protonen im Atomkern und zwei Elektronen in der Atomhülle.
Aufgabe 2.3
Elemente, die in den Hauptgruppen des Periodensystems untereinanderstehen, haben ganz ähnliche wichtige Verbindungen. Sie ähneln sich in ihrem chemischen Verhalten.
Im Schalenmodell der Elektronenhülle befindet sich immer eine bestimmte Anzahl Elektronen auf der äußersten Schale eines Elements.
- Stelle, mithilfe der Abbildung und der Tabelle zur Elektronenverteilung, eine begründete Vermutung auf warum sich die Elemente der Hauptgruppen (zum Beispiel: Lithium, Natrium, Kalium, ... oder Fluor, Chlor, Brom, ...) in ihrem chemischen Verhalten ähnlich sind.
- Begründe, warum die Edelgase eine besondere Stellung im Periodensystem einnehmen.
Elektronenverteilung
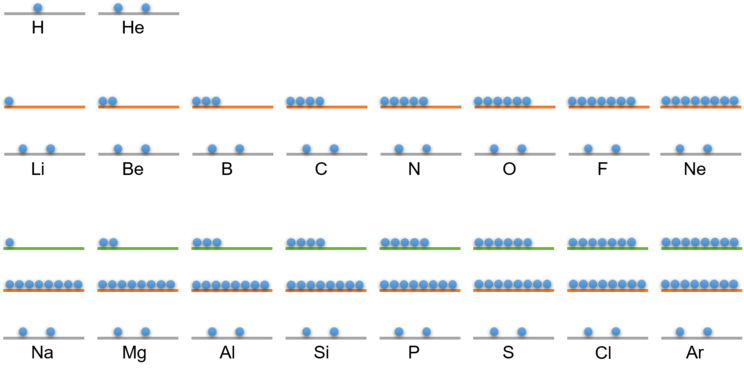
Die folgende Tabelle zeigt dir die Verteilung der Elektronen auf den Schalen für die ersten 18 Elemente:
Elektronen auf Schale 1 | Elektronen auf Schale 2 | Elektronen auf Schale 3 | |
1 H – Wasserstoff | 1 |
|
|
2 He – Helium | 2 |
|
|
3 Li – Lithium | 2 | 1 |
|
4 Be – Beryllium | 2 | 2 |
|
5 B – Bor | 2 | 3 |
|
6 C – Kohlenstoff | 2 | 4 |
|
7 N – Stickstoff | 2 | 5 |
|
8 O – Sauerstoff | 2 | 6 |
|
9 F – Fluor | 2 | 7 |
|
10 Ne – Neon | 2 | 8 |
|
11 Na – Natrium | 2 | 8 | 1 |
12 Mg – Magnesium | 2 | 8 | 2 |
13 Al – Aluminium | 2 | 8 | 3 |
14 Si – Silicium | 2 | 8 | 4 |
15 P – Phosphor | 2 | 8 | 5 |
16 S – Schwefel | 2 | 8 | 6 |
17 Cl – Chlor | 2 | 8 | 7 |
18 Ar – Argon | 2 | 8 | 8 |
Auflösung: Elektronenkonfiguration und Periodensystem
Für das ähnliche chemische Verhalten ist der Aufbau der Elektronenhülle entscheidend. Im Periodensystem werden die Elemente deshalb auch nach dem Aufbau ihrer Elektronenhülle angeordnet, wobei die Reihenfolge durch die Kernladungszahl festgelegt ist.
Alle Elemente, die die gleiche Anzahl von Schalen in der Elektronenhülle aufweisen, bilden eine Periode, das heißt eine Zeile im Periodensystem. In der 1. Schale befinden sich maximal zwei Elektronen. Daher gibt es in der 1. Periode nur zwei Elemente: Wasserstoff hat ein Elektron, Helium hat zwei Elektronen.
Die 2. Schale kann maximal von acht Elektronen besetzt werden. In der 2. Periode stehen deshalb acht Elemente vom Lithium (Li) bis zum Neon (Ne). Mit dem Element Natrium (Na) beginnt die Besetzung der 3. Schale.
Die Verteilung der Elektronen auf die einzelnen Schalen wird als Elektronenkonfiguration (Elektronenanordnung oder -verteilung) bezeichnet. Wie man diese darstellt, hast du in Baustein 7.2 erarbeitet.
Das Natrium-Atom hat also ein Elektron in der äußeren Schale. Ebenso haben auch die Atome des Wasserstoffs und der anderen Alkalimetalle ein Elektron in der äußeren Schale. Sie stehen in einer Spalte untereinander und bilden die 1. Hauptgruppe. Der Wasserstoff hat dabei aber eine besondere Stellung: Wasserstoff ist kein Metall und verhält sich chemisch, nicht wie die anderen Elemente der 1. Hauptgruppe. Elemente mit zwei Elektronen in der äußeren Schale bilden die 2. Hauptgruppe (Ausnahme: Helium). Dieses Prinzip gilt für alle Hauptgruppen.
Die Edelgase nehmen eine besondere Stellung im Periodensystem ein, da ihre äußerste Schale, die Valenzschale, voll mit Elektronen besetzt ist. Dieser Zustand wird Edelgaskonfiguration genannt und ist besonders stabil. Daher bilden Edelgase auch (fast) keine Verbindungen mit anderen Elementen.