Navigation
Material
Hier findest du das Material für diese Station.
-
 Tabelle: Kernladung und Atommasse Diese Tabelle beinhaltet die Elemente mit der Kernladung 1 bis 84 und ihre Atommasse.
Tabelle: Kernladung und Atommasse Diese Tabelle beinhaltet die Elemente mit der Kernladung 1 bis 84 und ihre Atommasse.
Station 1: Die Ladung des Kerns und die Atommasse
Navigation durch die Stationen
Für sein Modell zum Aufbau eines Atoms nahm Ernest Rutherford an, dass die Ladung des Atomkerns grob proportional zur Masse des Atoms ist.
Er kam zu dieser Schlussfolgerung, da die Streuung der positiven α-Teilchen von der Ladung des Kerns abhängig ist und die α-Teilchen umso mehr gestreut wurden, je größer die Atommasse des Elements ist.
Zur Zeit Rutherfords gab es nicht die Möglichkeit die Ladung der Atomkerne genau zu bestimmen. Die Atommassen waren dagegen schon seit langer Zeit immer wieder und immer genauer bestimmt worden. Daher war dieser „Umweg“ für Rutherford notwendig.
Heute kennen wir die Ladung der Atomkerne, die Kernladungszahl, sehr genau und können sie auch mit der Atommasse in Relation setzen.
Aufgabe
Erstelle in Excel eine Tabelle nach folgendem Prinzip:
| Element | Kernladung | Atommasse (u) |
|---|---|---|
| Wasserstoff | 1 | 1,0079 |
| Helium | 2 | 4,0026 |
| Lithium | 3 | 6,9675 |
| Beryllium | 4 | 9,0122 |
| Bor | 5 | 10,813 |
| Kohlenstoff | 6 | 12,011 |
| ... |
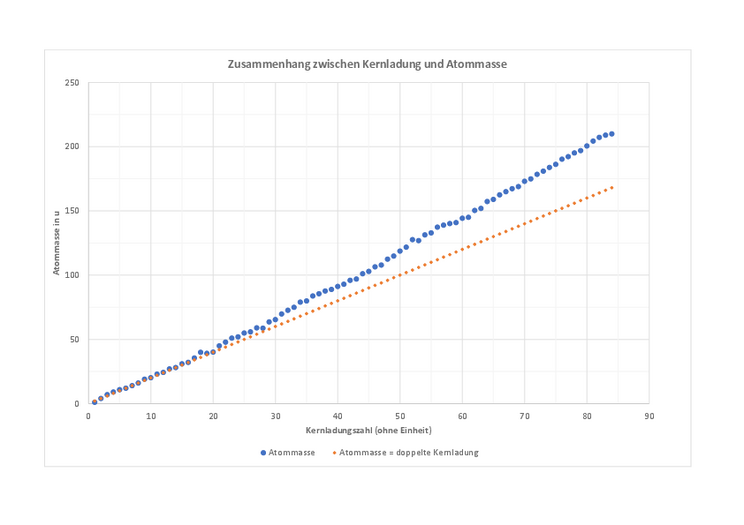
Nutze verschiedene, mindestens 25, Elemente von Kernladung 1 bis 84. Die Daten dafür findest du in der Tabelle unter Material. Erstelle dann ein Diagramm, dass den Zusammenhang zwischen Kernladung und Atommasse zeigt.
Füge auch die lineare Funktion: Atommasse = 2∙Kernladung in das Diagramm ein.
- Beschreibe den Zusammenhang zwischen Kernladung und Atommasse, den du aus den Daten und dem Diagramm erkennen kannst.
- Ist der Zusammenhang linear?
- In welchem Bereich stimmt er mit der linearen Funktion Atommasse = 2∙Kernladung überein und in welchem Bereich nicht?