Navigation
Baustein 7.1 Emissionsspektren
Das Experiment Flammenfärbung zeigt dir ein Phänomen, welches bereits für die Naturwissenschaftler im gesamten 19. Jahrhundert eine unerklärte Erscheinung war: Elemente senden, wenn sie angeregt werden, Licht in ganz bestimmten Wellenlängen aus, auch wenn unser Auge nur eine bestimmte Farbwahrnehmung hat, so ist auch dieses Licht eine Mischung unterschiedlicher Farben mit ganz bestimmten Wellenlängen.
Die Anregung der Elemente geschieht durch Zufuhr von Energie. In diesem Fall durch die Wärmeenergie der Brennerflamme. Bei Feuerwerkskörpern wird das Leuchten auch durch Wärmeenergie angeregt, in Leuchtröhren durch elektrische Energie. Du konntest durch das Handspektroskop die sogenannten Emissionsspektren der Elemente erkennen. Die folgende Abbildung zeigt dir eine Übersicht der Emissionsspektren einiger Elemente.

Die Linien, die ein Element im Emissionsspektrum zeigt, sind immer die gleichen und sie sind spezifisch für das jeweilige Element. Daraus können wir ableiten, dass der Ursprung dieser Linien im Aufbau der Atome des Elements liegen muss. Die Atome eines Elements müssen alle eine Gemeinsamkeit haben, die sich von den Atomen anderer Elemente unterscheidet.
Das Rutherfordsche Modell zum Aufbau des Atoms kann uns keine Erklärung für die Entstehung der Emissionsspektren liefern. Wir müssen unser Modell also erweitern.
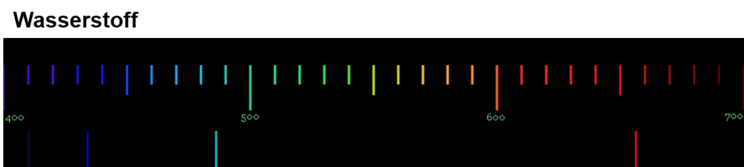
Von besonderem Interesse für die Wissenschaftler war das Emissionsspektrum von Wasserstoff, da es das Element ist, dessen Atome den einfachsten Aufbau haben. Sie hofften daher, dass sie die Ursache und die Gesetze der Lichtemission anhand des Wasserstoffspektrums erklären könnten. Das Emissionsspektrum von Wasserstoff kann mit Hilfe einer Leuchtröhre, die mit Wasserstoffgas gefüllt ist, erzeugt werden. Das Spektrum von Wasserstoff besteht aus 4 Linien im sichtbaren Bereich. Ihre Wellenlängen sind von links nach rechts: 410, 434, 486 und 656 nm.
Die folgende Abbildung zeigt dir das Emissionsspektrum von Wasserstoff.
Experimentelle Aufnahme von Emissionsspektren
Die folgenden Bilder zeigen beispielhaft einen Versuchsaufbau zur Aufnahme des Emissionsspektrums von Wasserstoff und das endgültige Ergebnis. Dafür wurde eine Wasserstofflampe, ein optischer Spalt, ein optisches Gitter sowie ein einfacher Schirm mit gebleichtem Papier verwendet. Beachte, dass aufgrund der Versuchsanordnung das langwelligere rote Licht links auf dem Schirm erscheint und nicht, wie oben, rechts. Außerdem sind die Abstände der Linien nicht, wie oben, maßstabsgetreu auf einer Skala anzuordnen.
Zur Aufnahme des Spektrums empfiehlt es sich den Raum komplett abzudunkeln und eine Kamera mit automatischer Einstellung der Belichtungszeit zu verwenden. Moderne Smartphones eignen sich dafür auch.
Das Max-Planck-Institut für Plasmaphysik stellt auf seiner Seite eine Bauanleitung für ein Handyspektrometer zur Verfügung. Handyspektrometer






