Navigation
Baustein 7.4 Das Schalenmodell
Du hast in den letzten Bausteinen gelernt, dass die Elektronen in der Atomhülle durch die Aufnahme von Energie unterschiedlich hohe Energiestufen einnehmen können und von diesen, durch die Abgabe von Energie, wieder in niedrigere Energiestufen übergehen können. Dieser Prozess ist die Ursache für die Emission der spezifischen Linienspektren der Elemente.
Wir können uns nun also vorstellen, dass es in der Atomhülle verschiedene, erlaubte, Zustände für die Elektronen gibt, doch es bleibt die Frage, wie genau sich die Elektronen eines Atoms dort verteilen.
Mit dieser Frage beschäftigte sich ab 1913 auch der Physiker Niels Bohr. Er stellte ein Modell zum Aufbau der Atome auf, dass heute als Bohr'sches Atommodell oder auch Schalenmodell bekannt ist.
Er berechnete wichtige Eigenschaften der Energiestufen der Elektronen und nutzte die periodischen Eigenschaften der Elemente, um die Verteilung der Elektronen auf den Energiestufen zu bestimmen.
Die folgende Tabelle zeigt dir die Verteilung der Elektronen auf den Energiestufen für die ersten 18 Elemente:
| Elektronen auf Energiestufe n = 1 | Elektronen auf Energiestufe n = 2 | Elektronen auf Energiestufe n = 3 |
1 H – Wasserstoff | 1 |
|
|
2 He – Helium | 2 |
|
|
3 Li – Lithium | 2 | 1 |
|
4 Be – Beryllium | 2 | 2 |
|
5 B – Bor | 2 | 3 |
|
6 C – Kohlenstoff | 2 | 4 |
|
7 N – Stickstoff | 2 | 5 |
|
8 O – Sauerstoff | 2 | 6 |
|
9 F – Fluor | 2 | 7 |
|
10 Ne – Neon | 2 | 8 |
|
11 Na – Natrium | 2 | 8 | 1 |
12 Mg – Magnesium | 2 | 8 | 2 |
13 Al – Aluminium | 2 | 8 | 3 |
14 Si – Silicium | 2 | 8 | 4 |
15 P – Phosphor | 2 | 8 | 5 |
16 S – Schwefel | 2 | 8 | 6 |
17 Cl – Chlor | 2 | 8 | 7 |
18 Ar – Argon | 2 | 8 | 8 |
Aufgabe
- Begründe mit Hilfe der Tabelle zur Elektronenverteilung, warum sich die Elemente der Hauptgruppen in ihrem chemischen Verhalten ähnlich sind.
- Begründe warum die Edelgase eine besondere Stellung im Periodensystem einnehmen.
- Wie viele Elektronen würden sich nach diesem Prinzip auf der nächsten Energiestufe n = 4 befinden?
Chemisches Verhalten und Elektronenverteilung ab der 4. Periode
Die Elemente einer Hauptgruppe verhalten sich chemisch so ähnlich, da sie auf ihrer obersten Energiestufe immer die gleiche Anzahl an Elektronen haben. Diese bestimmen das Reaktionsverhalten der Elemente.
Die Edelgase nehmen dabei eine besondere Stellung ein, ihre oberste Energiestufe ist voll besetzt und damit besonders stabil. Daher reagieren sie nur sehr schwer mit anderen Elementen.
Auf der nächsten Energiestufe n = 4 können sich nach dem oben angegebenem Schema 18 Elektronen für die Elemente Kalium bis Krypton (19 bis 36) aufhalten.
Doch damit hätten die Elemente von Gallium bis Krypton (31 bis 36) nicht die gleiche Anzahl an Elektronen auf ihrem obersten Energieniveau, wie ihre verwandten Elemente in den Perioden 1 bis 3.
Bohr löste dieses Problem, indem er Unterstufen einführte. Die Elektronen der Elemente 21 bis 30 befinden sich demnach auf einer eigenen Energiestufe, auf der sich 10 Elektronen aufhalten können. Erst wenn diese Unterstufe voll ist, wird die Energiestufe n = 4 weiter aufgefüllt. Dies soll an einem Beispiel verdeutlicht werden:
Das Element Arsen besitzt 33 Elektronen in der Hülle. Die ersten 18 Elektronen befinden sich auf den ersten drei Energiestufen, wie in der Tabelle dargestellt. Die Elektronen 19 und 20 befinden sich auf der Energiestufe n = 4. Das 21. Elektron wird auf einer Unterstufe gebunden, auch das 22., 23. usw. bis die Unterstufe mit 10 Elektronen gefüllt ist. Ab dem 31. Elektron wird dann wieder die Energiestufe n = 4 aufgefüllt, bis sich auf ihr insgesamt 5 Elektronen befinden, sodass sich auch bei dem Element Arsen 5 Elektronen auf der obersten Energiestufe befinden. Man könnte diese, von Bohr eingeführte, Unterstufe etwa n = 4a nennen oder n = 4.1.
Schalen als Energiestufen
Ihr habt nun gelernt, wie sich die Elektronen auf den Energiestufen in der Atomhülle verteilen. Es bleibt aber die Frage offen, wie wir uns diese Energiestufen vorstellen können. Auch diese Frage versuchte Bohr zu beantworten.
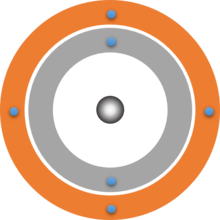
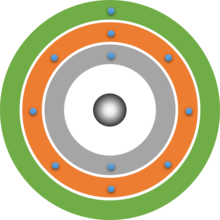
Schon das von Dalton aufgestellte Atommodell basierte auf der Vorstellung, dass Atome kugelform haben. Bohr konnte nun sogar berechnen, dass sich die Elektronen in einem bestimmten Abstand zum Atomkern befinden. Es bilden sich sogenannte Schalen um den Atomkern. Dieses Modell lässt sich ohne Probleme mit dem Modell der Energiestufen verbinden. Die Schale, die sich am nächsten zum Atomkern befindet, entspricht der niedrigsten Energiestufe n = 1. Auf dieser Schale finden 2 Elektronen Platz. Die nächste Schale ist weiter vom Kern entfernt und kann bis zu 8 Elektronen aufnehmen, dies ist die Energiestufe n = 2.
Auf diese Weise können wir uns schrittweise ein zweidimensionales Modell eines Atoms aus einem Kern und einer Hülle aus Elektronen aufbauen.
Aufgabe
- Zeichne mit Hilfe der Tabelle zur Elektronenverteilung und den Informationen aus dem vorherigen Text ein Schalenmodell eines Atoms der folgenden Elemente:
- Wasserstoff
- Helium
- Kohlenstoff
- Sauerstoff
- Natrium
- Chlor
Schalenmodelle von Atomen
Deine gezeichneten Schalenmodelle sollten ungefähr so aussehen wie die folgenden drei Beispiele. Beachte, dass hier die Atomkerne lediglich durch einfache graue Kugeln dargestellt sind. Der genaue Aufbau des Atomkerns wird hier nicht dargestellt. Er wird in Baustein 6 behandelt.
Zurück zum vorherigen Abschnitt
Energiestufen