Kontakt
Postanschrift
Besuchsanschrift
Spektroelektrochemie an Modellbiomembranen
Izabella Brand
Biomembranen sind die wichtigsten geladenen Grenzflächen in der Natur. Sie bestehen aus einer Lipiddoppelschicht und membranassoziierten Proteinen. Membranen stehen in ständiger Wechselwirkung mit Ionen, kleinen organischen Molekülen sowie mit Biomakromolekülen, die auf beiden Seiten der Membran vorhanden sind. Über die Membrane liegen sehr starke elektrische Felder an, die durch die ungleiche Verteilung von Ionen auf beiden Seiten der Membran hervorgerufen werden. Modellmembranen auf Elektroden können den Einfluss elektrischer Felder auf die Anordnung der molekularen Bestandteile der Membran in kontrollierter Weise nachbilden. Proteine gehören zur wichtigsten Klasse von Makromolekülen, die mit biologischen Membranen interagieren. In-situ-Strukturstudien der Proteinkonformation und -orientierung an Membranen sind äußerst anspruchsvoll. Die Polarisationsmodulations-Infrarotreflexions-Absorptionsspektroskopie (PM IRRAS) bietet die Möglichkeit, Konformationsänderungen in Proteinen, die mit Modellmembranen wechselwirken, in situ zu untersuchen. Wie in Abbildung 1 dargestellt, haben Proteine verschiedene Arten der Interaktion und Assoziation mit der Lipidmembran entwickelt. Diese unterschiedlichen Interaktionsmodi gehen mit Veränderungen der Proteinkonformation, der Sekundärstruktur und der Hydratation im Vergleich zur Proteinstruktur in der Lösungsphase einher.
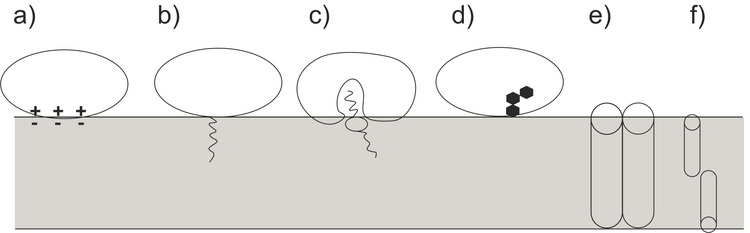
Abbildung 2 zeigt ein Beispiel aus unseren aktuellen Studien über das Lipidankerprotein, insbesondere die Assoziation des Proteins Recoverin mit der Membran bei verschiedenen Polarisationszuständen. Recoverin ist ein zytoplasmatisches Protein, das in Photorezeptorzellen vorkommt. Dieses Protein enthält eine Myristoylkette (C14). In Gegenwart von Ca2+ wird die C14-Kette in das hydrophobe Fragment einer Lipid-Doppelschichtmembran eingebaut. Abbildung 2 zeigt PM-IRRA-Spektren im Bereich der Amid-I'-Bande von Recoverin, wenn es mit einer Lipid-Doppelschicht assoziiert ist. Die verschieden Spektren wurden bei verschiedenen Potentialen der Au-Elektrode aufgezeichnet, auf der die Doppelschicht präpariert wurde. Unter Verwendung der zweiten Ableitung der gemessenen Spektren (untere Felder in Abbildung 2) wurde die Amid-I'-Bande in zwei Komponenten zerlegt, die mit ungeordneten Fragmenten (1670 cm-1, rot) und alpha-Helices (1648 cm-1, blau) assoziiert sind.
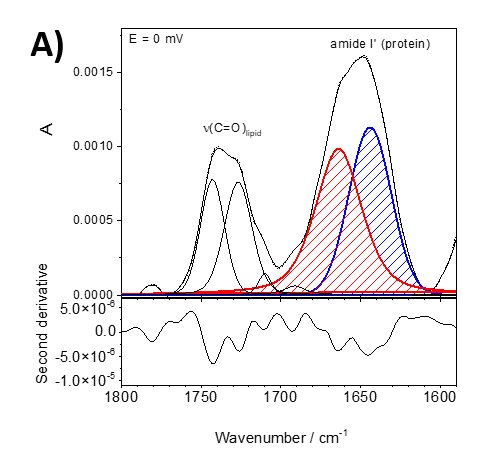
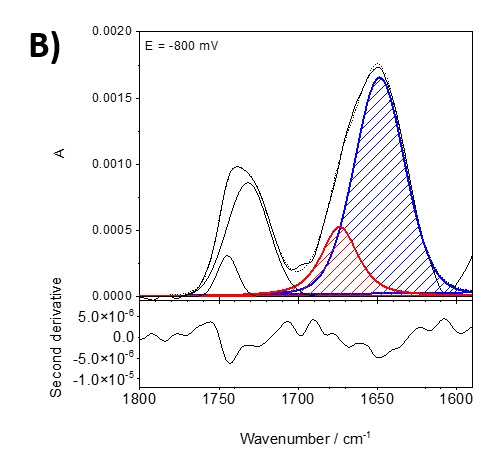
Abbildung 2. Angepasste in-situ PM-IRRA-Spektren (obere Tafel) und ihre zweite Ableitung (untere Tafel) im Spektralbereich 1800 - 1580 cm-1 der DMPC:Cholesterin-Lipid-Doppelschicht nach Wechselwirkung mit auf der Au-Oberfläche abgelagertem Recoverin. A) bei 0 mV, B) bei -800 mV.
Elektrische Potentiale haben einen großen Einfluss auf die Form und Intensität der Amid-I'-Bande, was auf potentialbedingte Veränderungen der Proteinkonformation und -orientierung hinweist. Diese Veränderungen sind bei veränderlichen Potential reversibel.
PM IRRAS reagiert empfindlich auf die Ausrichtung eines bestimmten Molekülfragments in einem anisotropen Film, wie z. B. einer Modellbiomembran. Nach der Oberflächenauswahlregel von IRRAS hängt die Intensität einer IR-Absorptionsmode in einem anisotropen Film von der Oberflächenkonzentration der an einer festen Oberfläche adsorbierten Moleküle und vom Winkel zwischen dem Übergangsdipolmoment und der Oberflächennormalen ab. Kennt man die Richtung des Übergangsdipolmoments innerhalb eines untersuchten Moleküls, kann der Winkel zwischen diesem Vektor und der Oberflächennormalen bestimmt werden. Wir haben diese Analysen für das Amid I' der helikalen Konformation durchgeführt, um die durchschnittliche Ausrichtung der Helices im membranassoziierten Zustand zu ermitteln. Diese Ergebnisse sind in Abbildung 3 dargestellt.
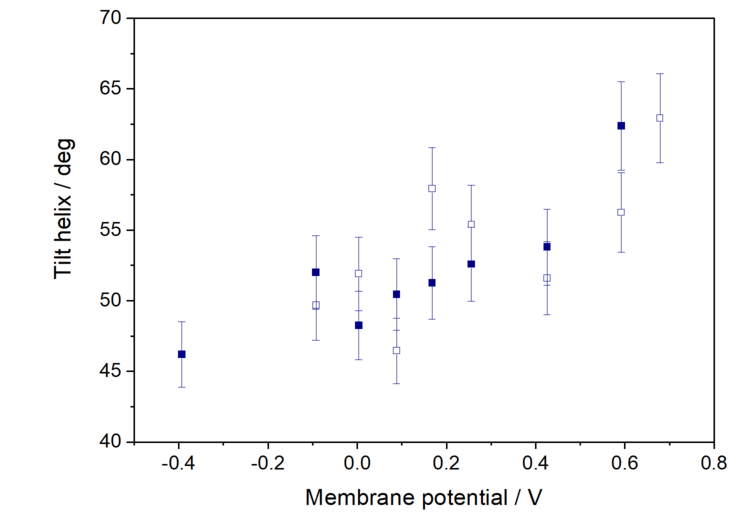
Bei positiven Membranpotentialen liegen die Helices bevorzugt parallel zur Membranoberfläche, und eine negative Potentialverschiebung bewirkt eine allmähliche Umorientierung des Proteins, die zur Entfernung der Myristoylkette führt. Dies steht im Zusammenhang mit der Neuausrichtung der Lipidmoleküle bei negativen Potentialen.
Dieses Beispiel veranschaulicht die Anwendbarkeit von in-situ PM IRRAS zur Untersuchung struktureller Veränderungen in supramolekularen Baugruppen auf submolekularer Ebene. Diese Studien sind nicht auf Modelle von Biomembranen beschränkt, sondern wurden auf die Untersuchung von:
- Elektrische Doppelschicht von ionischen Flüssigkeiten
- Potenzialbedingte Veränderungen in Monoschichten von redoxaktiven Metalltensiden mit gleichrichtenden Eigenschaften
- Potenzialbedingte Veränderungen der Konformation und Stabilität von DNA-Doppelhelixen, ihre Wechselwirkung mit kleinen zwitterionischen Molekülen und Enzymen
- Redox-aktive Polymerfilme
- Potentialabhängige Fehlfaltung von Proteinfilmen
- Korrosion von Leichtmetallen wie Magnesium oder Aluminium.

