Kontakt
Postanschrift
Besuchsanschrift
Sauerstoffelektroden für Lithium-Luft-Batterien
von Marius Muhle
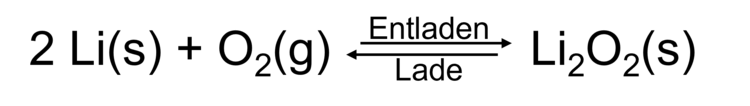
Lithium-Ionen-Batterien zeichnen sich durch eine sehr hohe Energiedichte und eine hohe Effizienz aus, weshalb sie für die Energie- und Mobilitätswende unerlässlich sind. Für die positiven Elektroden der Lithium-Ionen-Batterien sind Übergangsmetalle wie Co oder Ni notwendig, die nur begrenzt verfügbar sind und beim Abbau Umweltschäden verursachen. Die positiven Elektrode wird benötigt, um während des Entladens der Batterie die negative Elektrode zu oxidieren. Oxidationspozesse sind aus dem Alltag vor allem als Reaktionen mit Luftsauerstoff bekannt. Die Reaktion von Sauerstoff mit Lithium als vielversprechendes Material für negative Elektroden könnte in einer Lithium-Luft-Batterie genutzt werden. Die Reaktionsgleichung lautet wie folgt:
Aufgrund seines geringen Preises und seiner Ungiftigkeit könnte Sauerstoff ein guter Reaktionspartner an der positiven Elektrode sein. Auch die extrem hohe Energiedichte von Lithium-Luft-Batterien macht deren Entwicklung zu einem vielversprechenden Forschungsfeld.[1]
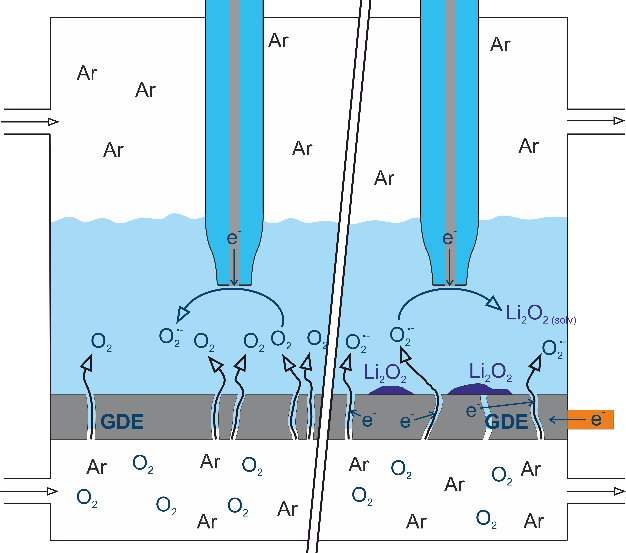
Allerdings stellt die Verwendung von Sauerstoff auch eine technische und chemische Herausforderung dar. Um die gewünschte Reaktion eingehen zu können, muss der gasförmige Sauerstoff im Batterieelektrolyten gelöst sein und Kontakt mit einem elektrischen Leiter haben, der die Elektronen bereitstellt/abführt. Dies wird mit Hilfe einer Gasdiffusionselektrode (GDE) erreicht, die elektrisch leitet, den Durchtritt von gasförmigem Sauerstoff in die Batterie ermöglicht, jedoch ein Auslaufen des Elektrolyten verhindert. In Abbildung 2 ist der Aufbau einer Lithium-Luft-Batterie dargestellt.

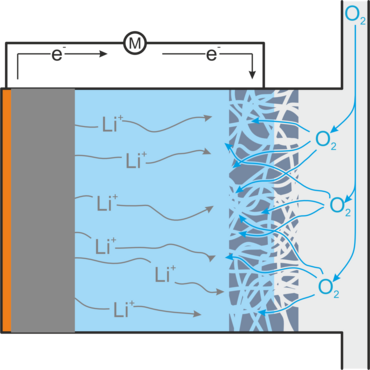
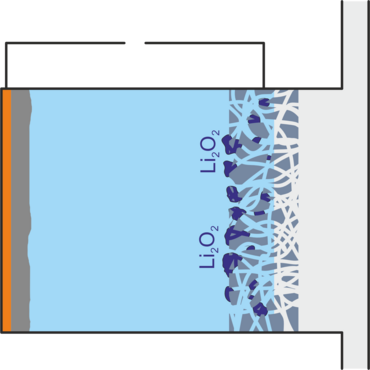
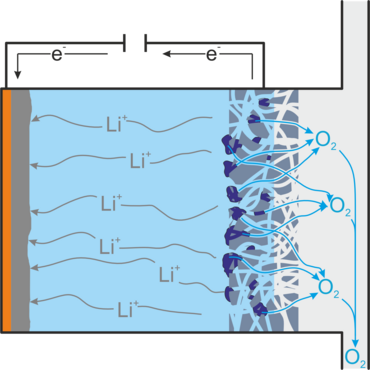
Beim Entladen der Batterie entsteht Lithiumperoxid, dass sich als Feststoff in der Gasdiffusionselektrode ablagert und diese so verstopfen kann. Außerdem entsteht hochreaktives Superoxid, das den Elektrolyten zersetzt und reaktionsträges Lithiumoxid, das nicht für eine Rückreaktion zugänglich ist. Beides verringert die Lebensdauer der Batterie. Zu weiteren ungewollten Nebenreaktionen kommt es, wenn Verunreinigungen wie Wasser und Kohlenstoffdioxid in die Batterie gelangen, so wie es bei der direkten Verwendung von Luft als Sauerstoffquelle der Fall wäre. Außerdem kann es vorkommen, dass Lithiumperoxidteilchen den Kontakt zur Gasdiffusionselektrode verlieren und so nicht mehr für die Aufladereaktion zugänglich sind.[1,2]
Eine mögliche in unserer Gruppe untersuchte Lösung für dieses Problem ist die Verwendung von Redox-Mediatoren im Elektrolyten. Die Verbindungen transportieren wie eine Fähre die Elektronen zwischne der Gassdiffusionselektrode und den Lithiumperoxid. Auf diese Weise können die für die Reaktion benötigten Elektronen zum Lithiumperoxid transferiert werden, ohne, dass dieses in einem elektronischen Kontakt mit der Gasdiffusionselektrode stehen muss.[3]
Um die Entwicklung der Lithium-Luft-Technologie voranzutreiben, ist ein noch besseres Verständnis der Vorgänge an der Gasdiffusionselektrode erforderlich. Mit Hilfe verschiedener Varianten der elektrochemischen Rastermikroskopie (SECM) wird in unserer Arbeitsgruppe die lokale Leitfähigkeit und Sauerstoffpermeabilität der Gasdiffusionselektrode in Abhängigkeit vom Ladezustand der Zelle gemessen. Um die Sauerstoffpermeabilität zu messen, strömt auf der einen Seite der Gasdiffusionselektrode ein sauerstoffhaltiges Gasgemisch. Auf der anderen Seite der Elektrode befindet sich eine Mikroelektrode in einer Elektrolytlösung, an der die Reaktion von in Lösung befindlichen Sauerstoffspezies detektiert werden kann.[4-6] In Abbildung 3 ist ein solcher Messaufbau abgebildet. Verschiedene Sauerstoffspezies können ebenfalls mit elektrochemischer Rastermikroskopie und zusätzlich durch Röntgen-Photoelektronenspektroskopie nachgewiesen werden.
Literatur
[1] W.-J. Kwak, Rosy, D. Sharon, C. Xia, H. Kim, L. R. Johnson, P. G. Bruce, L. F. Nazar, Y.-K. Sun, A. A. Frimer, M. Noked, S. A. Freunberger, D. Aurbach; Lithium-Oxygen Batteries and Related Systems: Potential, Status, and Future. Chem. Rev. 2020, 120, 6626–6683. https://doi.org/10.1021/acs.chemrev.9b00609
[2] R. Padbury, X. Zhang; Lithium–oxygen batteries—Limiting factors that affect performance. J. Power Sources 2011, 196, 4436–4444. https://doi.org/10.1016/j.jpowsour.2011.01.032
Eigene Beiträge zum Forschungsgebiet
[3] B. Krueger, K. K. Rücker, G. Wittstock
Redox Mediators for Faster Lithium Peroxide Oxidation in a Lithium-Oxygen Cell: A Scanning Electrochemical Microscopy Study
ACS Appl. Energy Mater. 2022, 5, 3724-3733. Abstract & Link
[4] P. Schwager, D. Fenske, G. Wittstock
Scanning electrochemical microscopy of oxygen permeation through air-electrodes in lithium–air batteries
J. Electroanal. Chem. 2015, 740, 82-87, Abstract & Link
[5] H. Bülter, P. Schwager, D. Fenske, G. Wittstock
Observation of Dynamic Interfacial Layers in Li-Ion and Li-O2 Batteries by Scanning Electrochemical Microscopy
Electrochim. Acta 2016, 199, 366-379. Abstract & Link
[6] P. Schwager, S. Dongmo, D. Fenske, G. Wittstock
Reactive oxygen species formed in organic lithium-oxygen batteries
Phys. Chem. Chem. Phys. 2016, 18, 10774-10780, Abstrac & Link

