Kontakt
Postanschrift
Besuchsanschrift
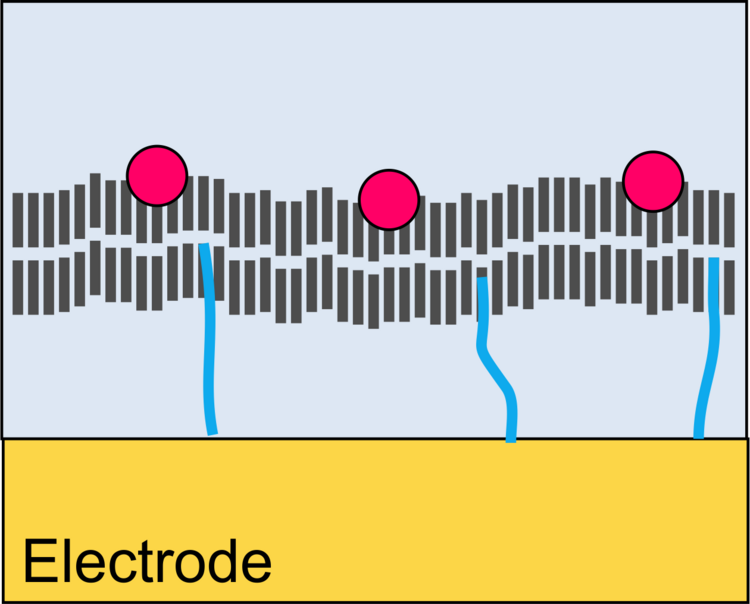
Aktivitätsabbildung immobilisierter Enzyme
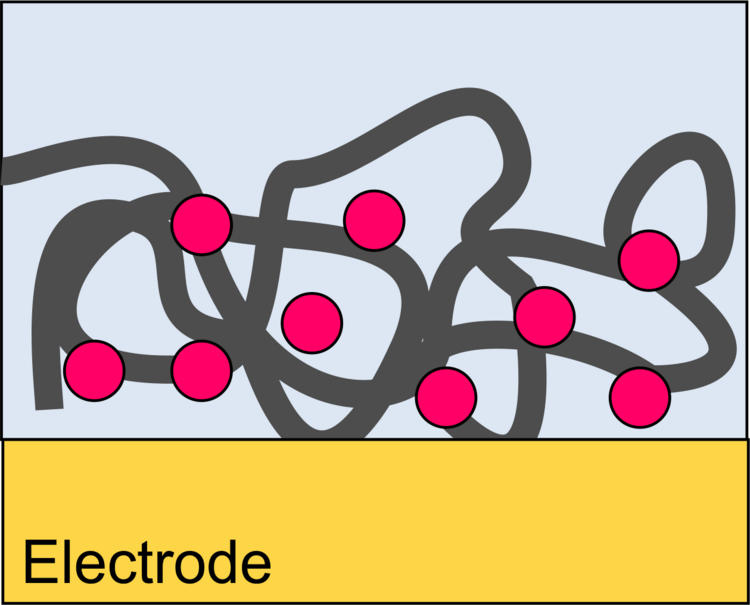
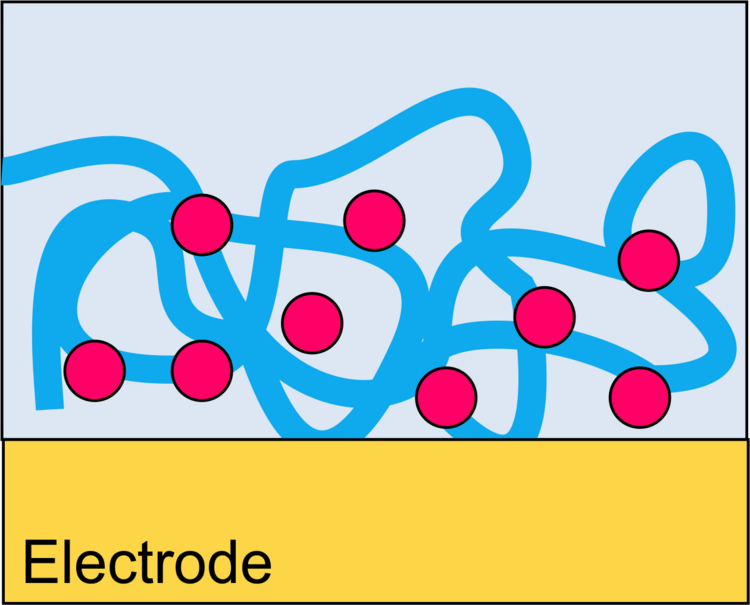
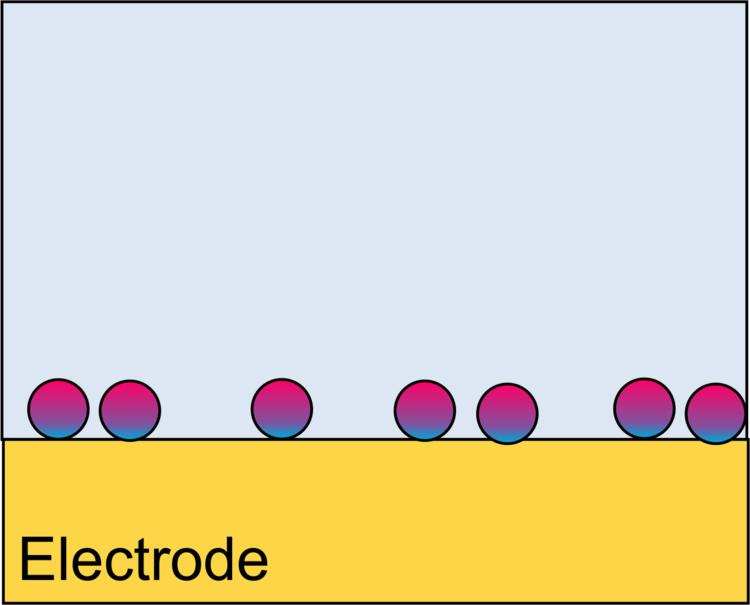
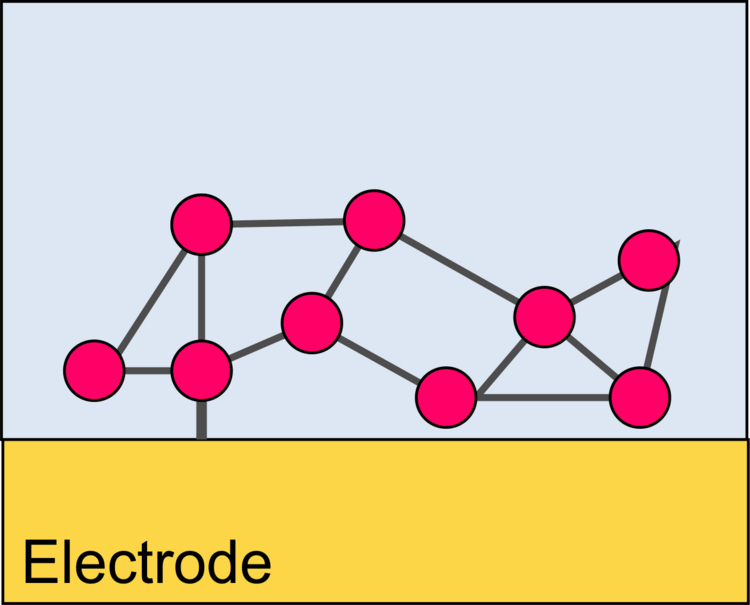
Anbindung von Proteinen an Oberflächen
Funktionale Kopplung enzymatischer Reaktionen mit Elektroden
Gestaltung der Grenzflächen
Reaktivitätsabbildung von immobilisierten Enzymen mit dem elektrochemischen Rastermikroskop
Die Abbildung der Aktivität von lokal immobilisierten Enzymen an Oberflächen kann mit der elektrochemischen Rastermikroskopie (SECM) in unterschiedlichen Varianten erfolgen.
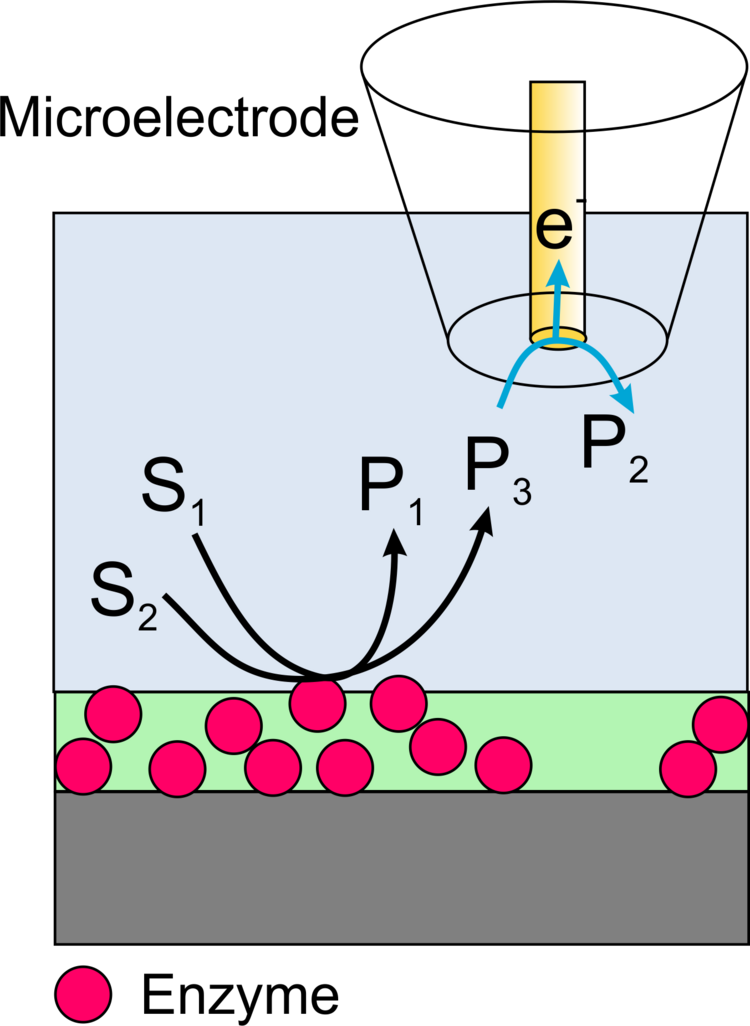
Abbildungen im Substrat-Generator/Spitzen-Kollektor-Modus
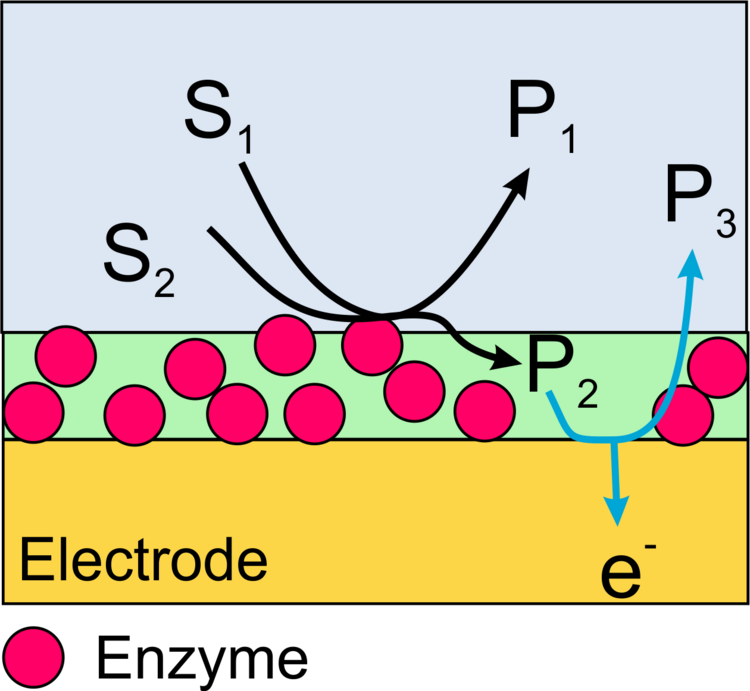
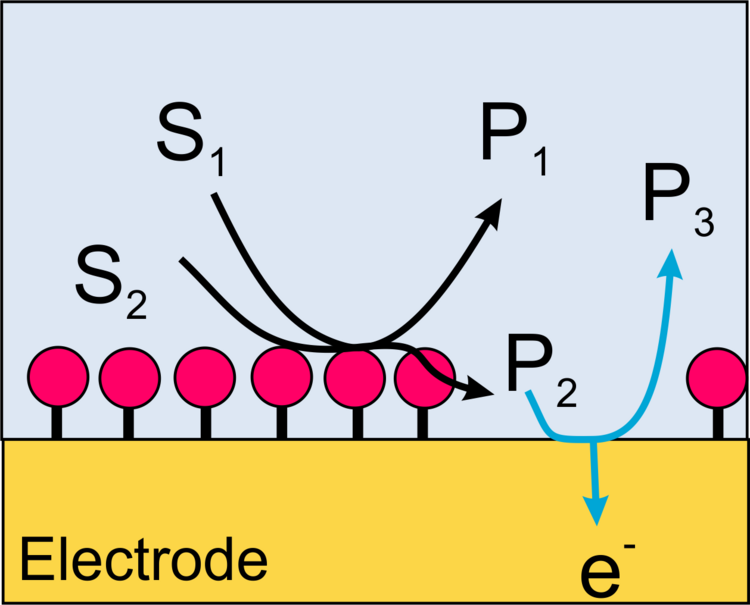
In diesem Fall ein vom Enzym gebildetes redoxaktives Produkt an der Mikroelektgrode des SECM oxidiert oder reduziert (Abbildung 13). Der Vorteil der Methode besteht in einer sehr hohen Empfindlichkeit und in der Möglichkeit neben Oxidoreduktasen auch die Aktivität anderer wichtiger Enzyme wie alkalischer Phosphatase oder Galactosidase zu messen. Der Nachteil besteht in der geringen Auflösung der Methode und spezellen Voraussetzungen, um diese Messungen quantitativ zu gestalten.
Beispiel: Abbildung der Aktivität von Galactosidase (Abbildung 14) nutzt den Umstand, dass beim Detektionspotential p-Aminopehnol oxidiert werden kann. Die Ausgangsverbindung aber nicht. Die Abbildung 15 zeigt eine Rasteraufnahme von drei modifizierten Oberflächenbereichen mit einer unterschiedlichen Menge des Enzymes Galactosidase. Eine Kurvenanpassung an eine Schnitlinie in Abbildung 16 kann zur quantitativen Ausbwertung genutzt werden.
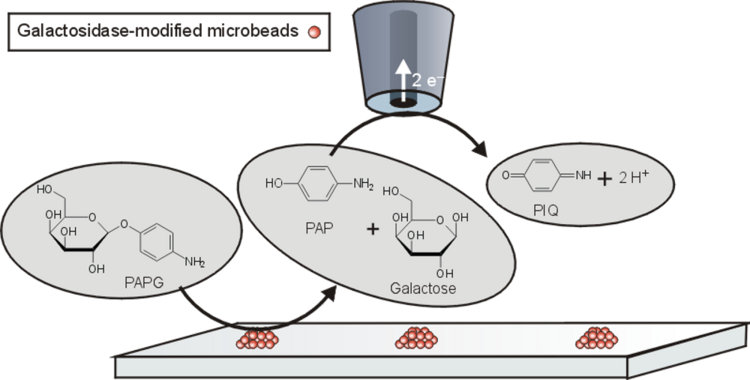
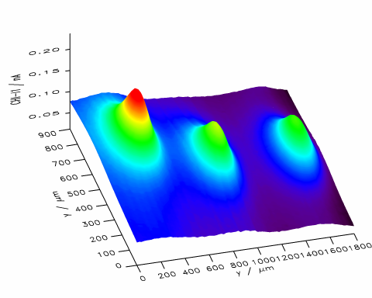
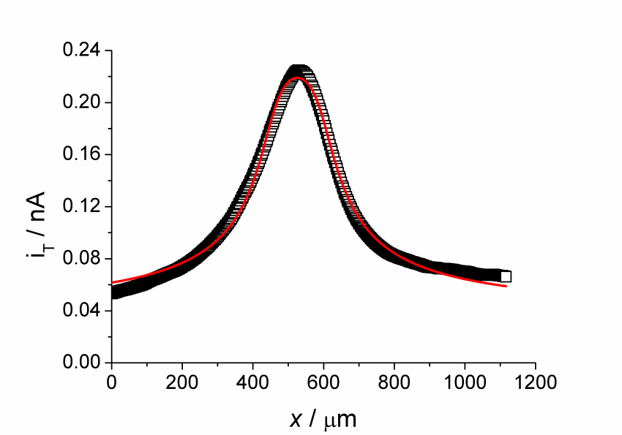
Abbildung im Feedback-Modus
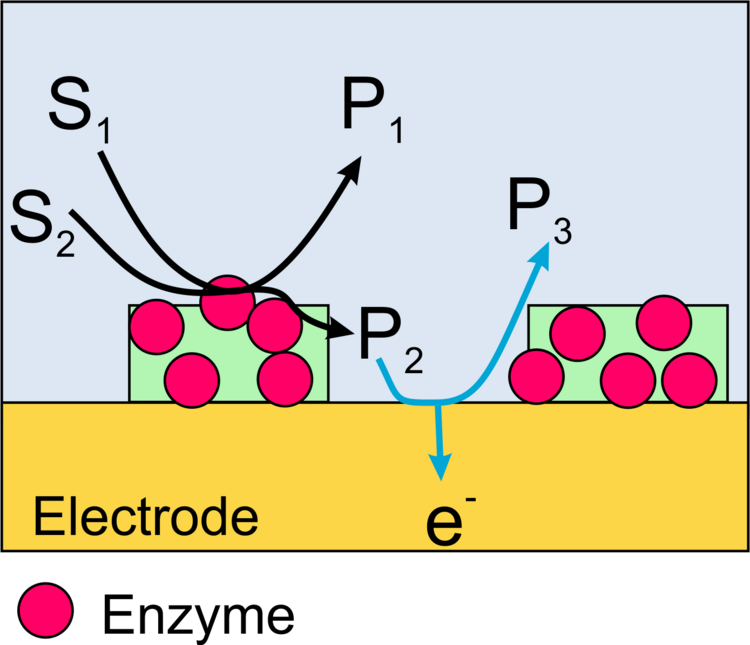
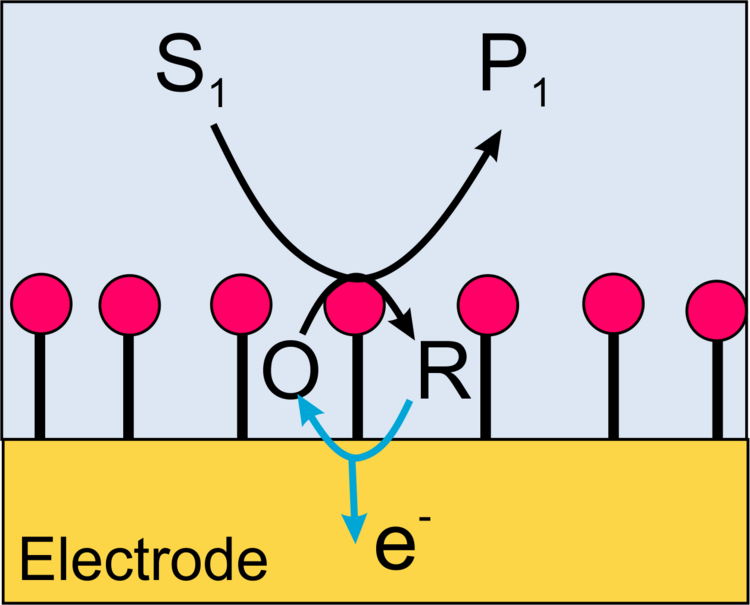
In diesem Fall wird die Funktion eines natürlicher Cosubstrat des Enzymes (etwa O2 bei Gluocoseoxidase) durch einen künstlichen Redoxmediator (etwa Ferrocenderivate für Glucoseoxidase) übernommen. An der Mikroelektrode des elektrochemischen Rastermikroskops wir der Mediator (R in Abbildung 17) kontinuierlich zu seiner oxidierten Form umgesetzt. Eine Stromverstärkung tritt auf, wenn der Mediator durch die zu detektierende enzymatische Reaktion an der Oberfläche regeneriert wird, indem der Mediator Elektronen von dem Enzym aufnimmt.
Der Vorteil der Methode besteht in der sehr gut berechenbaren quantitativen Beziehung zwischen dem Strom an der Mikroelektrode und der der Aktivität des immbilisierten Enzyms. Der Nachtei,besteht in der geringeren Empfindlichkeit im Vergleich zum Generator-Kollektor-Modus.
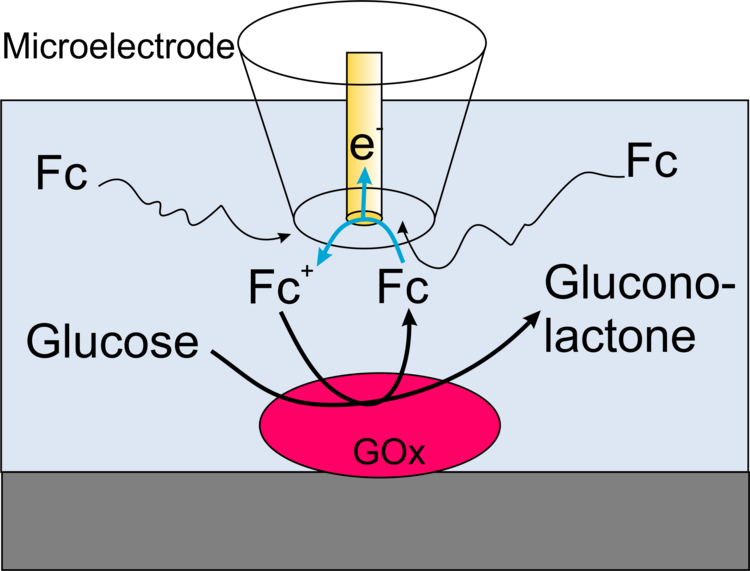
Beispiel: In der schematischen Darstellung der gekoppelten Reaktionen in Abbildung 17 ist erkennbar, dass die Oxidation von Glucose am Enzyme Glucoseoxidase (GOx) nur abläuft, wenn das an der Mikroelektrode oxidierte Ferrocenderivat zur verfügung steht. In der enzymatischen Reaktion wird die ursprüngliche Form des Mediators regeneriert und steht wieder für eine Oxidation an der Mikroelektrode zur Verfügung, wodurch sich der Strom erhöht. In der Beispielmessung in Abbildung 18 und in der Schnittlinie ist erkennbar, dass die Kanten wesentlich schärfer sind (höhere laterale Auflösung) als in den Abbildungen 15 und 16 unter ansosnten etwa vergleichbaren Bedingungen.
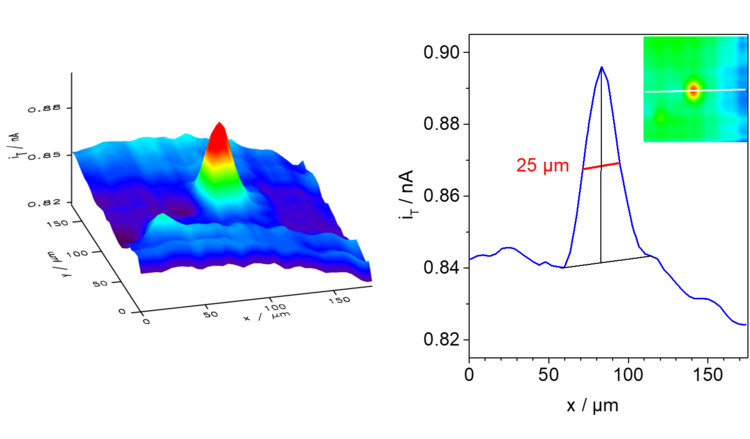
Abbildung im Redoxkompetitionsmodus
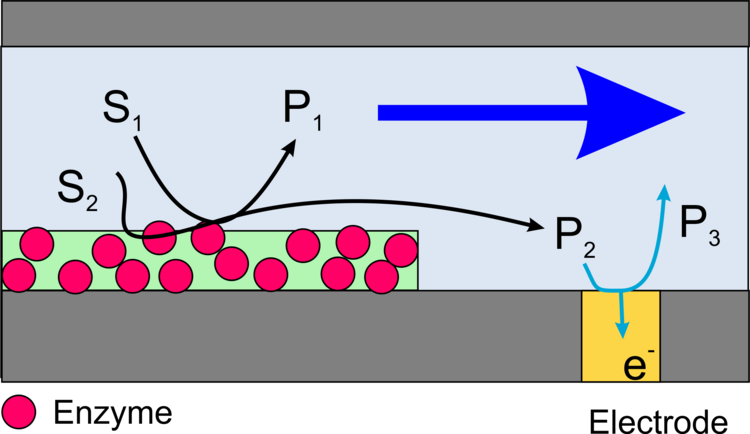
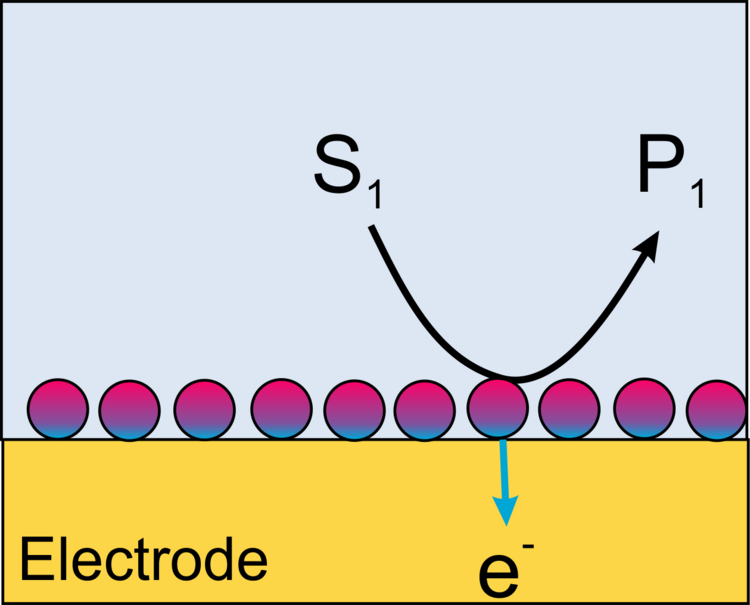
In Fällen, bei denen das Reaktionsprodukt der enzymatischen Reaktion Wasser, also das Lösungsmittel ist, kann der Generator-Kollektor-Modus nicht eingesetzt werden. In diesen Fällen kann der Kompetionsmodus zur Anwendung kommen.

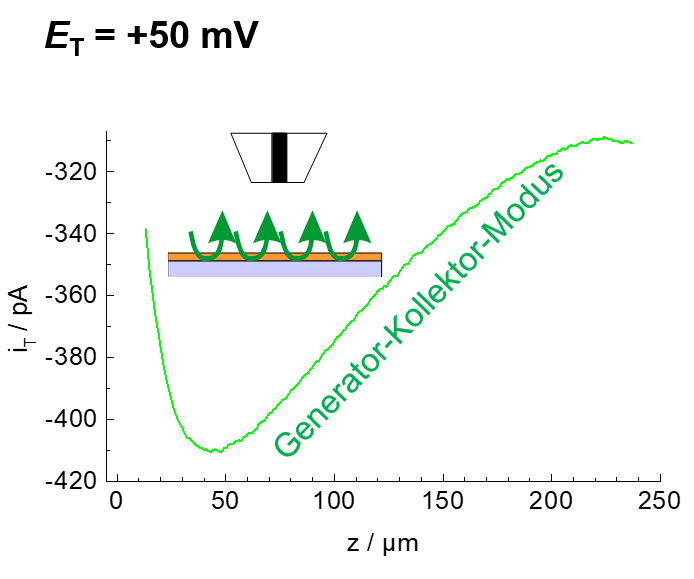
Beispiel: Das Enzym Meerrettichperoxidase (horse radish peroxidase, HRP) setzt Wasserstoffperoxid H2O2 zu Wasser um. Die Elektronen können von einem künstlichen Elektronendonor (hier Ferrocenmethanol, Fc) geliefert werden (Abbildung 19). Die Aktivität des Enzyms lässt sich entweder im Generator-Kollektor-Modus durch Detektion oxidierten Ferrocenform (Ferrocenium, Fc+) messen (Abbildung 20). Dabei enteht ein Reduktionsstrom an er Mikroelektrode (Auftragung nach unten). Eine andere Variante ist der Einsatz des Redoxkompetionsmodus (Abbildung 21). Hier konkurrieren die enzymmodifizierte Probe und die Mikroelektorde um das Cosubstrat Fc. Je kleiner der Strom an der Mikroelektrode, desto größer ist die Aktivität der Probe und umso mehr Fc wird dort verbraucht. Die Abbildungen 20 und 21 zeigen Annäherungskurven. Das sind Auftragungen des Stroms an der Mikroelektrode gegenüber dem Abstand zwischen Mikroelektrode und Probe. Je steiler die Kurve verläuft, desto besser ist die resultierende Auflösung in zweidimensionalen Abbildungen. Annäherungskurven können auch sehr gut für mechanistische Untersuchungen eingesetzt werden.

Eigene Beiträge zu dem Gebiet
Übersichtsartikel
- B. R. Horrocks, G. Wittstock
Biotechnological Applications in Scanning Electrochemical Microscopy
in Scanning Electrochemical Microscopy, 3rd ed. (A. J. Bard, M. V. Mirkin, Eds.), CRC Press, Boca Raton 2022, Chap. 10, pp. 243-296. Abstract & Link - G. Wittstock, M. Burchardt, S. E. Pust, Y. Shen, C. Zhao
Scanning Electrochemical Microscopy for Direct Imaging of Reaction Rates
Angew. Chem. Int. Ed. 2007, 46, 1584-1617. Abstract & Link
- T. Wilhelm, G. Wittstock
Analysis of Interaction in Patterned Multienzyme Layers by Using Scanning Electrochemical Microscopy
Angew. Chem. Int. Ed. 2003, 42, 2247-2250. Abstract & Link - T. Wilhelm, G. Wittstock
Analyse von Wechselwirkungen in gemusterten Multi-Enzymschichten mit elektrochemischer Rastermikroskopie (SECM)
Angew. Chem. 2003, 115, 2350-2353. Abstract & Link - G. Wittstock
Modification and characterization of artificially patterned enzymatically active surfaces by scanning electrochemical microscopy
Fresenius J. Anal. Chem. 2001, 370, 303-315. Abstract & Link
Untersuchung von Systemen mit zwei interagierenden Enzymen
- M. Burchardt, G. Wittstock,
Micropatterned Multienzyme Devices with Adjustable Amounts of Immobilized Enzymes,
Langmuir 2013, 29 (48), 15090-15099, Abstract & Link - C. Zhao, G. Wittstock
An SECM detection scheme with improved sensitivity and lateral resolution: Detection iof galactosidase activity with signal amplification by glucose dehydrogenase
Angew. Chem. Int. Ed. 2004, 43, 4170-4172. Abstract & Link - C. Zhao, G. Wittstock
Ein SECM-Detektionsmodus mit verbesserter Empfindlichkeit und lateraler Auflösung: Detektion von Galactosidaseactivität mit Signalverstärkung durch Glucosedehydrogenase
Angew. Chem. 2004, 116, 4264-4267. Abstract & Link - G. Wittstock, W. Schuhmann
Formation and Imaging of Microscopic Enzymatically Active Spots on an Alkanethiolate-Covered Gold Electrode by Scanning Electrochemical Microscopy
Anal. Chem. 1997, 69, 5059-5066. Abstract & Link
Aktivitätsabbildung biotechnologisch wichtiger Enzyme
- Nogala, A. Celebanska, G.Wittstock, M.Opallo
Bioelectrocatalytic Carbon Ceramic Gas Electrode for Reduction of Dioxygen and Its Application in a Zinc–Dioxygen Cell
Fuel Cells 2010, 6, 1157-1163. Abstract & Link - Nogala, K. Szot, M. Burchardt, F. Roelfs, J. Rogalski, M. Opallo, G. Wittstock
Feedback mode SECM study of laccase and bilirubin oxidase immobilised in a sol–gel processed silicate film
Analyst 2010, 135, 2051–2058. Abstract & Link - Nogala, A. Celebanska, K. Szot, G. Wittstock, M. Opallo
Bioelectrocatalytic mediatorless dioxygen reduction at carbon ceramic electrodes modified with bilirubin oxidase
Electrochim. Acta 2010, 55, 5719–5724. Abstract & Link - W. Nogala, K. Szot, M. Burchardt, M. Joensson-Niedziolka, J. Rogalski, G. Wittstock, M. Opallo
Scanning electrochemical microscopy activity mapping of electrodes modified with laccase encapsulated in sol–gel processed matrix
Bioelectrochemistry 2010, 79, 101-107. Abstract & Link - C. Nunes Kirchner, M. Träuble, G. Wittstock
Study of Diffusion and Reaction in Microbead Agglomerates
Anal. Chem. 2010, 82, 2626-2635. Abstract & Link - M. Burchardt, M. Träuble, G. Wittstock
Digital Simulation of Scanning Electrochemical Microscopy Approach Curves to Enzyme Films with Michaelis-Menten Kinetics
Anal. Chem. 2009, 81, 4857–4863. Abstract & Link - P. C. Chen, R. L. C. Chen, T. J. Cheng, G. Wittstock
Localized Deposition of Chitosan as Matrix for Enzyme Immobilization
Electroanalysis 2009, 21, 804-810. Abstract & Link - K. Szot, W. Nogala, J. Niedziolka-Jönssona, M. Jönsson-Niedziolka, F. Marken, J. Rogalski, C. Nunes Kirchner, G. Wittstock, M. Opallo
Hydrophilic carbon nanoparticle-laccase thin film electrode for mediatorless dioxygen reduction SECM activity mapping and application in zinc-dioxygen battery
Electrochim. Acta 2009, 54, 4620–4625. Abstract & Link - M. J. W. Ludden, J. K. Sinha, G. Wittstock, D. N. Reinhoudt, J. Huskens
Control over binding stoichiometry and specificity in the supramolecular immobilization of cytochrome c on a molecular printboard
Org. Biomol. Chem. 2008, 6, 1553-1557. Abstract & Link - W. Nogala, M. Burchardt, J. Rogalski, M. Opallo, G. Wittstock
Scanning electrochemical microscopy study of laccase within a sol-gel processed silicate film
Bioelectrochemistry 2008, 72, 174-182. Abstract & Link - M. Burchardt, G. Wittstock
Kinetic studies of glucose oxidase in polyelectrolyte multilayer films by means of scanning electrochemical microscopy (SECM)
Bioelectrochemistry 2008, 72, 66-76. Abstract & Link - C. Nunes Kirchner, S. Szunerits, G. Wittstock
Scanning electrochemical microscopy (SECM) based detection of oligonucleotide hybridization and simultaneous determination of the surface concentration of immobilized oligonucleotides on gold
Electroanalysis 2007, 19, 1258-1267. Abstract & Link - C. Nunes Kirchner, C. Zhao, G. Wittstock
Analysis of the activity of beta-galactosidase from Escherichia coli by scanning electrochemical microscopy (SECM)
Comprehensive Analytical Chemistry 2007, 49, e371-e379. Abstract & Link - C. Nunes Kirchner, G. Wittstock
Kinetic analysis of titanium nitride thin films by scanning electrochemical microscopy
Comprehensive Analytical Chemistry 2007, 49, e363-e370. Abstract & Link - G. Wittstock, M. Burchardt, C. Nunes Kirchner
Scanning electrochemical microscopy in biosensor research
Comprehensive Analytical Chemistry 2007, 49, 907-939. Abstract & Link - M. Zhang, G. Wittstock, Y. Shao, H. H. Girault
Scanning Electrochemical Microscopy as a Readout Tool for Protein Electrophoresis
Anal. Chem. 2007, 79, 4833-4839. Abstract & Link - O. Sklyar, M. Träuble, C. Zhao, G. Wittstock
Modeling Steady-State Experiments with a Scanning Electrochemical Microscope Involving Several Independent Diffusing Species Using the Boundary Element Method
J. Phys. Chem. B 2006, 110, 15869-15877. Abstract & Link - C. Zhao, G. Wittstock
Scanning electrochemical microscopy for detection of Biosensor and biochip surfaces with immobilized pyrroloquinone (PQQ)-dependent glucose dehydrogenase as enzyme label
Biosens. Bioelectron. 2005, 20, 1277-1284. Abstract & Link - C. Zhao, J. Sinha, C. A. Wijayawardhana, G. Wittstock
Monitoring beta-Galactosidase Activity by Means of Scanning Electrochemical Microscopy
J. Electroanal. Chem. 2004, 561, 83-91. Abstract & Link - C. Zhao, G. Wittstock
Scanning Electrochemical Microscopy of Quinoprotein Glucose Dehydrogenase
Anal. Chem. 2004, 76, 3145-3154. Abstract & Link - T. Wilhelm, G. Wittstock
Generation of Periodic Enzyme Patterns by Soft Lithography and Activity Imaging by Scanning Electrochemical Microscopy.
Langmuir 2002, 18, 9486-9493. Abstract & Link - G. Wittstock, T. Wilhelm
Characterization and Manipulation of Microscopic Biochemically Active Regions by Scanning Electrochemical Microscopy (SECM)
Anal. Sci. 2002, 18, 1199-1204. Abstract & Link - T. Wilhelm, G. Wittstock
Patterns of functional proteins formed by local electrochemical desorption of self-assembled monolayers
Electrochim. Acta 2001, 47, 275-281. Abstract & Link - G. Wittstock, T. Wilhelm, S. Bahrs, P. Steinrücke
SECM feedback imaging of enzymatic activity on agglomerated microbeads
Electroanalysis 2001, 13, 669-675. Abstract & Link - C. A. Wijayawardhana, N. J. Ronkainen-Matsuno, S. M. Farrel, G. Wittstock, H. B. Halsall, W. R. Heineman
Microspot Enzyme Assays with Scanning Electrochemical Microscopy
Anal. Sci. 2001, 17 Supplement, 535-538. Abstract & Link - J. Zaumseil, G. Wittstock, S. Bahrs, P. Steinrücke
Imaging the activity of nitrate reductase by means of a scanning electrochemical microscope
Fresenius J. Anal. Chem. 2000, 367, 346-351. Abstract & Link - C. A. Wijayawardhana, G. Wittstock, H. B. Halsall, W. R. Heineman
Electrochemical Immunoassay with Microscopic Immunomagnetic Bead Domains and Scanning Electrochemical Microscopy
Electroanalysis 2000, 12, 640-644. Abstract & Link - C.A. Wijayawardhana, G. Wittstock, H.B. Halsall, W.R. Heineman
Spatially Addressed Deposition and Imaging of Biochemically Active Bead Microstructures by Scanning Electrochemical Microscopy
Anal. Chem. 2000, 72, 333-338. Abstract & Link - T. Wilhelm, G. Wittstock, R. Szargan
Scanning electrochemical microscopy of enzymes immobilized on structured glass-gold substrates
Fresenius J. Anal. Chem. 1999, 365, 163- 167. Abstract & Link - C. Kranz, G. Wittstock, H. Wohlschläger, W. Schuhmann
Imaging of Microstructured Biochemically Active Surfaces with Scanning Electrochemical Microscopy
Electrochim. Acta 1997, 42, 3105-3111. Abstract & Link - G. Wittstock, R. Hesse, W. Schuhmann
Patterned Self-Assembled Alkanethiolate Monolayers on Gold. Patterning and Imaging by Means of Scanning Electrochemical Microscopy
Electroanalysis 1997, 9, 746-750. Abstract & Link - G. Wittstock, K. Yu, H. B. Halsall, T. H. Ridgway, W. R. Heineman
Imaging of Immobilized Antibody Layers with Scanning Electrochemical Microscopy
Anal. Chem. 1995, 67, 3578-3582. Abstract & Link