Arbeitsblätter
Hier findest du die Arbeitsblätter für diesen Baustein.
Arbeitsblatt Flammenfärbung
-
 Arbeitsblatt Flammenfärbung Auf diesem Arbeitsblatt findest du die Anleitung für das Experiment Flammenfärbung.
Arbeitsblatt Flammenfärbung Auf diesem Arbeitsblatt findest du die Anleitung für das Experiment Flammenfärbung.
Baustein 7.1: Die Flammenfärbung
Licht und Farbe
Sicher hast du schon mal eine CD oder DVD in der Hand gehabt, aber hast du sie dir schon mal ganz genau angeschaut?
Aufgabe 7.1.1
Nimm dir eine CD oder DVD und halte die Unterseite in das Licht, drehe und wende sie.
Beschreibe deine Beobachtungen.
Rückseite einer DVD im Sonnenlicht
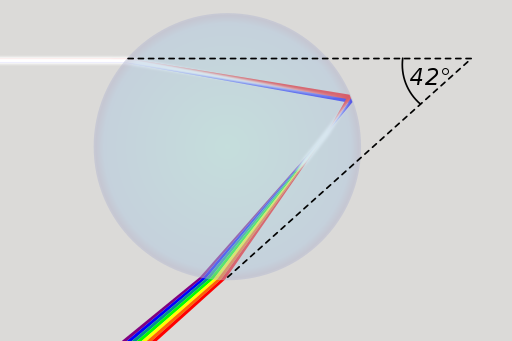
Du kannst an dieser DVD ein Naturphänomen wahrnehmen, welches dem Regenbogen ähnlich ist. An einer CD oder DVD wird das Licht durch Beugung an der speziellen Oberfläche in seine Farben zerlegt. Bei einem Regenbogen geschieht das durch Lichtbrechung in Regentropfen.
DVD-Oberfläche und Lichtbrechung im Regentropfen
Dieses Bild zeigt die Oberfläche einer DVD. Diese ist aus vielen kleinen aufeinanderfolgenden Furchen aufgebaut ist. Das Bild wurde mit einem Rasterkraftmikroskop aufgenommen.

Dieses Bild zeigt, wie weißes Sonnenlicht in einem Regentropfen gebrochen wird, sodass man alle Spektralfarben in einem Regenbogen sehen kann.
Diese Phänomene zeigen uns vor allem eines: Das Sonnenlicht, wie wir es kennen, ist nicht einfach „nur weißes Licht“, sondern setzt sich aus allen Farben des Farbspektrums zusammen. Wir können Licht physikalisch-mathematisch als Welle charakterisieren und die Farben, die wir wahrnehmen, über ihre jeweilige Wellenlänge beschreiben. Der sichtbare Bereich des Lichtes reicht vom violetten Licht mit einer Wellenlänge von etwa 400 nm bis hin zum roten Licht, das eine Wellenlänge von bis zu 750 nm hat. Unterhalb von 400 nm liegt der Bereich des ultravioletten Lichtes (UV-Strahlung), oberhalb von etwa 750 nm liegt der Bereich des infraroten Lichtes.
Es gibt aber auch Lichtquellen, die kein weißes Licht ausstrahlen. Du kennst sicher Beispiele, etwa Leuchtröhren, wie die Neonröhre, oder Feuerwerk, das in vielen unterschiedlichen Farben leuchten kann.
Aufgabe 7.1.2
Wie können wir untersuchen, ob das Licht von solchen Lichtquellen auch aus unterschiedlichen Farben zusammengesetzt ist?
Führe dafür das Experiment: Flammenfärbung durch. Wenn ihr das Experiment nicht in der Schule durchführen könnt, sieh dir alternativ das Video zu dem Experiment an.
Bearbeite anschließend die folgenden Aufgaben:
- Beschreibe deine Beobachtungen, wenn du die Flamme ohne und mit Handspektroskop betrachtest.
- Stelle eine begründete Vermutung auf, durch welches Element der verschiedenen Salze die unterschiedlichen Färbungen der Flamme hervorgerufen werden.
- Beurteile, ob du diese Beobachtungen mit dem aktuellen Atommodell erklären kannst.
Video: Experiment zur Flammenfärbung
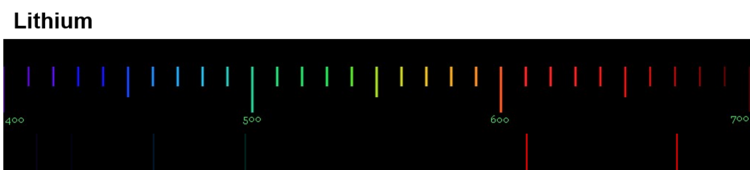
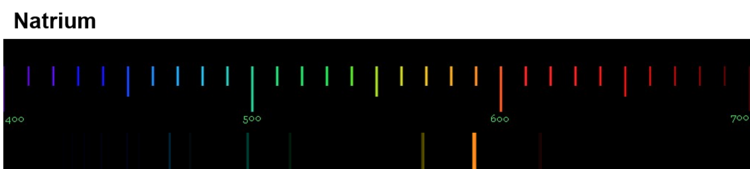
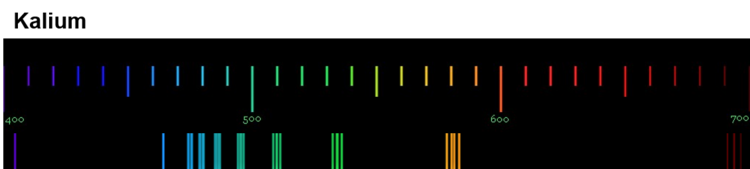
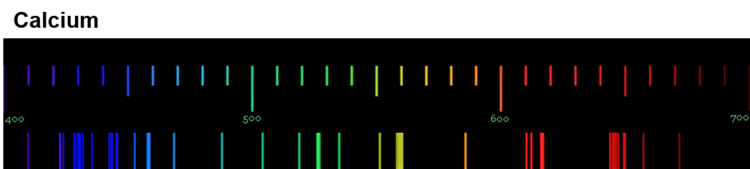
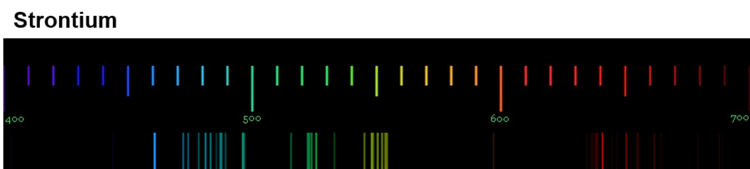
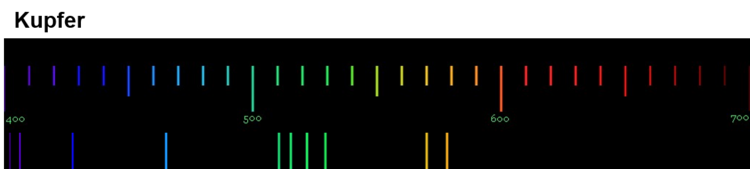
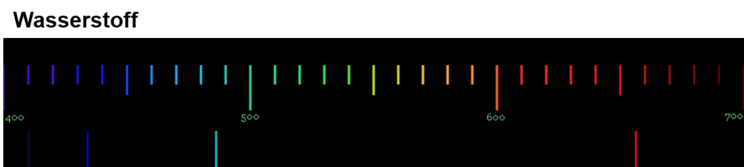
Diese Spektren sind etwas ganz Besonderes. Die Linien, die ein Element im Emissionsspektrum zeigt, sind immer gleich und zwei Elemente haben niemals das gleiche Spektrum.
Wenn diese Spektren also für jedes Element einzigartig sind, bedeutet das: Die Ursache dieses Phänomens muss im Aufbau der Atome des Elements liegen! Alle Atome eines Elements müssen eine Gemeinsamkeit haben, die sie von den Atomen anderer Elemente unterscheidet.
Um die Entstehung der Emissionsspektren erklären zu können, musst du noch etwas mehr über Licht und Energie erfahren:
Albert Einstein konnte im Jahr 1905 zeigen, dass die Energie des Lichtes abhängig von seiner Wellenlänge ist. Außerdem kann diese Energie auch nur in definierten „Portionen“, sogenannten Energiequanten, aufgenommen und abgegeben werden. Das bedeutet: Das Licht, welches die Elemente aussenden, hat genau die Energie, die vorher durch das Atom aufgenommen wurde.
Für die Erklärung der einzigartigen Emissionsspektren ist das sehr wichtig: Jede Linie eines Spektrums steht für eine ganz bestimmte Energie. Und weil jedes Element ein einzigartiges Spektrum hat, bedeutet das: Jedes Atom eines bestimmten Elements kann auch nur ganz bestimmte Energiebeträge aufnehmen und abgeben.
Wir können also sagen: Die Atome eines Elements haben Energiestufen.
Wir wissen aber noch nicht wie diese Aufnahme und Abgabe von Energie abläuft. Das sollst du jetzt erfahren.
Elektronen können Energie aufnehmen und abgeben
Bisher stellen wir uns das Atom als Kugel vor. Wir wissen auch, dass die kleinen, leichten Elektronen, die Träger negativer Ladung, ein Baustein der Atome sind.
Wie sich die Elektronen verteilen wissen wir nicht, aber sie sind im Atom nicht fest gebunden. Das konntest du schon in Baustein 3 erfahren, als du, nur durch Reibung Dinge aufladen konntest. Einstein fand heraus, dass die Elektronen in den Atomen Energie aufnehmen und abgeben können und so zwischen den sogenannten Energiestufen "hin und her springen".
Nun stellt sich die Frage: Wie können wir uns diese Energiestufen vorstellen und wie verteilen sich die Elektronen eigentlich?
Die Antwort auf diese Frage findest du in Baustein 7.3.