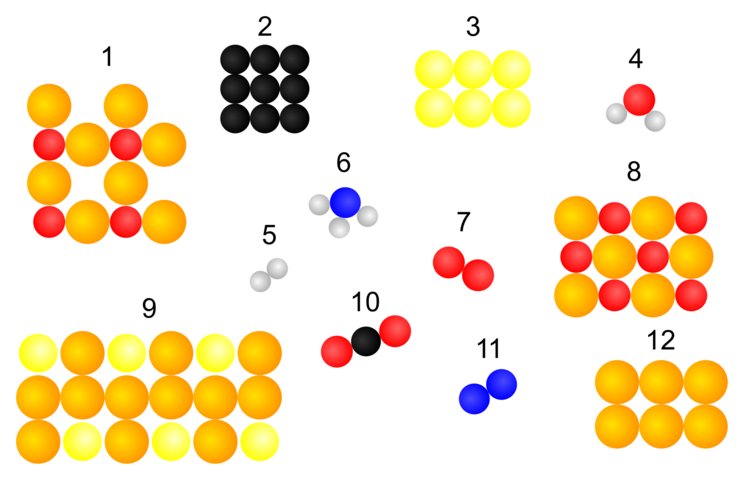
Baustein 1: Das Daltonsche Atommodell
Eine Darstellung von Elementen und Verbindungen
Aufgabe 1.1
Stelle begründete Vermutungen auf, um welche Elemente und Verbindungen es sich handeln könnte.
Historische Darstellungsweise
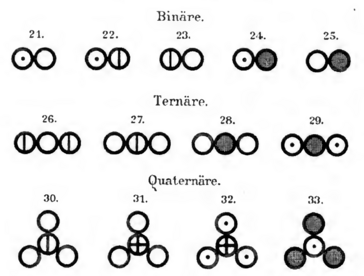
Die folgenden beiden Abbildungen zeigen dir Tabellen von John Dalton aus dem Jahr 1808. Er führte mit Hilfe dieser Abbildungen ein Modell ein, mit dem Elemente und Verbindungen dargestellt werden konnten.
Deshalb ist das Modell, auf dessen Grundlage die Darstellung der Elemente und Verbindungen am Anfang dieser Seite beruht, auch nach ihm benannt: Das Daltonsche Atommodell.
Aufgabe 1.2
- Vergleiche die Darstellung der Elemente und Verbindungen von Dalton mit denen am Anfang dieser Seite.
- Nenne und erläutere Gemeinsamkeiten und Unterschiede in den Darstellungsweisen.
Daltons Hypothesen
Dalton stellte Anfang des 19. Jahrhunderts, auf Grundlage seiner Untersuchungen der Eigenschaften von unterschiedlichen Gasen in seiner Arbeit „A New System of Chemical Philosophy“ die Hypothese auf, dass jeder Stoff aus kleinsten, nicht weiter teilbaren Teilchen, den Atomen, besteht. Darauf aufbauend machte er weitere Annahmen:
- Die Atome eines Elements sind gleich in ihrer Größe und Masse; Atome unterschiedlicher Elemente unterscheiden sich in ihrer Größe und Masse.
- Atome können nicht geteilt, erzeugt oder vernichtet werden.
- Bei einer chemischen Reaktion werden die Atome der Ausgangsstoffe neu angeordnet und in bestimmten Anzahlverhältnissen miteinander verbunden.
Auf Grundlage von Daltons Annahmen können verschiedene Phänomene erklärt werden. Er suchte auch nach einer Einheit für die Atommasse. Er wusste, dass es zu seiner Zeit keine Möglichkeit gab, um die tatsächlichen Massen der Atome zu bestimmen. Sie waren viel zu klein.
Dalton wählte deshalb als Einheit die Masse des leichtesten Atoms – die des Wasserstoffatoms. Dieser Atommasse gab er den Wert 1. Damit verglich er dann die Massen der anderen Atome und kam zu den Ergebnissen, die du im Zusatzmaterial in der linken Spalte findest. Diese Werte bezeichnet man als relative Atommassen. Sie stellen also nicht die tatsächlichen Atommassen dar, sondern nur die Atommassen im Vergleich mit der Masse eines Wasserstoffatoms. Er war einer der ersten Wissenschaftler, der auf Grundlage experimenteller Ergebnisse eine Tabelle mit relativen Atommassen erstellte. Die heutige atomare Masseneinheit unit (u) wurde daher früher auch als Dalton (Da) bezeichnet. Ein Wasserstoffatom hat die relative Atommasse 1 u.
Aufgabe 1.3
Mithilfe des Daltonschen Atommodells können wir einige Phänomene chemischer Reaktionen erklären und diese auch nutzen.
- Erläutere in eigenen Worten, mit Bezug zu Daltons Annahmen, die folgenden Beobachtungen:
- Bei einer chemischen Reaktion bleibt die gesamte Masse der beteiligten Stoffe erhalten.
- Verbinden sich 2 oder mehr Elemente zu einer bestimmten Verbindung, dann geschieht dies immer in einem bestimmten, konstanten Massenverhältnis.
- Beispiel: 88,81 g Sauerstoff reagieren immer mit 11,19 g Wasserstoff zu 100 g Wasser.
- Berechne welche Masse an Kohlenstoffdioxid entsteht, wenn 24 g Kohlenstoff vollständig verbrannt werden.