Station 2: Isotope
Der Aufbau des Atomkerns
Was du aus Station 1 mitgenommen hast:
Der Kern eines Atoms ist aus den einfach positiv geladenen Protonen und den ungeladenen Neutronen aufgebaut. Beide Teilchen haben eine Masse von ziemlich genau 1 u.
Da ein Atom nach außen elektrisch neutral ist (also ungeladen), sind in der Atomhülle immer so viele Elektronen wie Protonen im Kern. Ein Elektron hat eine so geringe Masse, dass fast die gesamte Masse eines Atoms, von den Protonen und Neutronen bestimmt wird.
Ein Beispiel: Ein Goldatomkern ist aus 79 Protonen und 118 Neutronen aufgebaut. Die Masse dieses Atomkerns ist also 197 u. Die 79 Elektronen in der Hülle wiegen zusammen nur etwa 0,04 u.
Wie können wir erklären, dass die Atommasse des Elements Chlor 35,45 u ist, wenn die Masse nur durch Protonen und Neutronen bestimmt wird und diese 1 u wiegen?
Diese Frage greifen wir später in dieser Station wieder auf und du wirst sie dann beantworten können.
Ein Element, unterschiedliche Massen
Zu Beginn des 20. Jahrhunderts fanden Wissenschaftler durch die Erforschung radioaktiver Strahlung und radioaktiver Elemente etwas Seltsames heraus: Es gab Atome, die zum selben Element gehörten, sich also chemisch genau gleich verhalten, aber unterschiedliche Atommassen hatten.
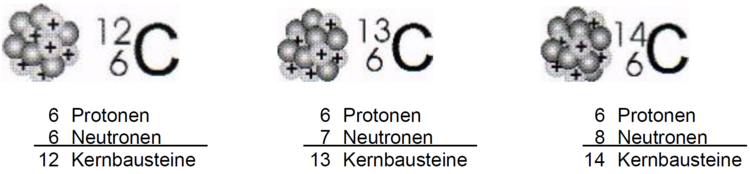
Das wurde zuerst bei sehr schweren Elementen wie bspw. Uran festgestellt. Heute wissen wir zum Beispiel aber auch, dass fast alle Kohlenstoffatome die Masse 12 u haben, aber einige wenige Kohlenstoffatome eine Masse von 13 u oder 14 u haben. Alle Kohlenstoffatome enthalten aber 6 Protonen in ihrem Kern und 6 Elektronen in der Atomhülle. Ihre Kerne können aber unterschiedlich viele Neutronen enthalten: 6, 7 oder sogar 8.
Isotope
Diese Atomsorten, deren Atomkerne die gleiche Anzahl an Protonen haben, aber unterschiedlich viele Neutronen, bezeichnet man als Isotope.
Isotope kommen aber nicht nur bei schweren radioaktiven Elementen oder Kohlenstoff vor. Durch die sogenannte Massenspektrometrie konnte bei vielen verschiedenen Elementen die Existenz von Isotopen gezeigt werden. Auch andere natürlich vorkommende Elemente, wie zum Beispiel Chlor oder Neon bestehen aus Atomen, deren Atomkerne unterschiedliche Massen besitzen.
Das sogenannte Isotopenverhältnis gibt die relative Häufigkeit der Isotope eines Elements an.
Ein Beispiel: Die Atome des Elements Silber kommen in der Natur mit den Massen 107 u und 109 u vor. Die Kerne der Atome unterscheiden sich durch 2 Neutronen mehr oder weniger. Wenn du 100 Atome Silber hättest und diese wiegen könntest, wären davon etwa 52 Atome 107 u schwer und 48 Atome wären 109 u schwer. Die relative Häufigkeit ist 52 % zu 48 %. Dieses Verhältnis ist immer gleich.
Aufgabe 6.2.1
- Erkläre den Begriff "Isotop" mit deinen eigenen Worten. Nutze dazu die Abbildung der Kohlenstoffisotope unten.
- Alle Atomkerne des Elements Chlor enthalten 17 Protonen. Die Atommasse im Periodensystem wird mit 35,45 u angegeben. Erkläre wie diese Atommasse zustande kommen kann.
- "Alle Atome eines Elementes sind gleich." Bewerte diese Aussage kritisch. Entwickle eine präzisere Aussage.
Tipp für Teilaufgabe 2
Chloratome kommen in der Natur als Isotope mit 18 und mit 20 Neutronen im Kern vor.