Molekulare und zelluläre Neurobiologie
Molekulare und zelluläre Neurobiologie

Phospholipidderivate: neue Perspektiven in der Medizin
Neuronale Membranen bestehen hauptsächlich aus Phospholipiden und diese Wiederum bilden die physikochemische Umgebung für Membranproteine, wie z. B. Rezeptoren. Außerdem liegen Neurotransmitter in Phospholipidvesikeln vor, so dass Freisetzung und Wiederaufnahme maßgeblich von der intakten Anordnung der Phospholipide abhängigen ist. Schließlich spielen Phospholipide und ihre Fettsäurekomponenten selbst eine zentrale Rolle in vielen Signalsystemen der Zelle.
Neuste Befunde zeigen, dass Phospholipide nach Gehirnverletzungen und degenerativen Gehirnerkrankungen vermehrt im ZNS Gewebe vorkommen. Die repulsiven Eigenschaften dieser Phospholipide könnten die Regeneration negativ beeinflussen. Die Regulation der Phospholipid-induzierten Signalkaskaden, die unter anderem Retraktion von Neuriten auslösen, könnte ein möglicher neuer Ansatzpunkt für Therapiestrategien nach akutem Schädel-Hirn-Trauma, aber auch in neurodegenerativen Erkrankungen, wie M. Alzheimer, M. Parkinson, Multiple Sklerose liegen. Bis heute haben wir keine wirksamen Medikamente und Therapiestrategien um neurodegenerative Erkrankungen zu heilen. Die bisherigen therapeutischen Interventionen erfolgen in der neurodegenerativen Kaskade zu spät, der Prozess der Degeneration kann nur schwer aufgehalten werden und auch die Rettung der noch vorhandenen Neuronen kann nicht zu einer restitutio ad integrum führen. Hier benötigen wir mehr detailliertere Kenntnisse der Mechanismen, die zu einer Regeneration von Nervenfasern führen können, um gezielte diagnostische Biomarker zur Früherkennung von neurodegenerativen Erkrankung einsetzen zu können, als auch neue Therapiestrategien zu entwickeln, um in die Regulation axonalem Auswachsen spezifisch eingreifen zu können.
Plasticity Related Genes
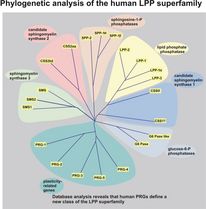
Die Abteilung Bräuer beschäftigt sich seit mehreren Jahren mit der Identifizierung molekularer Mechanismen während der neuronalen Entwicklung und bei De- und Regenerationsprozessen im adulten zentralen und peripheren Nervensystem. Bräuer und Kollegen identifizierten eine neue hirnspezifische Klasse von Proteinen, die LPPRs/PRGs (Strauss & Bräuer, 2013; Brindley & Bräuer, 2010; Bräuer & Nitsch, 2008). Diese sindentwicklungsabhängig exprimiert und an Umbauprozessen im ZNS und PNS beteiligt, indem sie Phospholipide modifizieren bzw. in deren Signalwege eingreifen (Coiro et al., 2014; Velmans et al., 2013, Trimbuch et al., 2009; Peeva et al., 2006; Savaskan et al., 2004). Die Daten zur funktionellen Relevanz von Phospholipiden weisen auf eine regulatorische Rolle in der neuronalen Transmission hin (Trimbuch et al., 2009), deren Mechanismen derzeit geklärt werden. Die zeitliche und räumliche Regulation der Phospholipide ist ein sensibler Prozess, der im Wesentlichen von Lipidphosphatasen, den Phospholipid-Rezeptoren und dem autokrinen Motilitätsfaktor ATX abhängt. Bräuer und Kollegen konnten die ATX-Expression während der Entwicklung und im adulten Gehirn in Oligodendrozyten-Vorläuferzellen nachweisen (Savaskan et al., 2007). Weiterhin ist eine Hochregulation von ATX in reaktiven Astrozyten nach Hirntrauma (Savaskan et al., 2007) nachgewiesen worden. Da ATX Lysophosphatidylcholin (LPC) zu LPA hydrolysiert, lässt diese Proteinexpression vermuten, dass es auch zur vermehrten LPA-Synthese nach Hirnschädigung kommt.
Zelluläre und molekulare Mechanismen der Neurodegeneration: Beteiligung und Rolle von Sphingolipiden
Veränderte Regulationen von Glykosphingolipid (GSL), speziell der Ganglioside, werden mit Fehlfaltung und Aggregation von Proteinen, die mit Neurodegeneration im Zusammenhang stehen, assoziiert. Als GSL bezeichnet man eine Gruppe von Lipiden (sogenannte "Sphingolipide"), die am Aufbau von Zellmembranen beteiligt sind. Ganglioside finden sich vor allem in den Zellmembranen von Zellen des zentralen Nervensystems. Dort erfüllen sie über ihre Kohlenhydratgruppe Aufgaben bei der Interaktion zwischen einzelnen Zellen, wie beispielsweise der Signalübertragung. Es ist bekannt, dass die abnormale Akkumulation von Gangliosiden eine Schlüsselrolle in der Pathogenese verschiedenster Erkrankungen, wie z.B. Sandhoff, Tay-Sachs und Gaucher Erkrankung spielt. Gangliosid-Akkumulation ist aber auch eine gemeinsame Eigenschaft von scheinbar ganz verschiedenen neurodegenerativen Krankheiten wie der Niemann-Pick Typ C1 (NPC) und Alzheimer Erkrankung (AD). NPC ist eine lysosomale Lipidspeicherkrankheit, die autosomal rezessiv vererbt wird. In Deutschland sind nur ca. 500 - 700 Erkrankungsfälle bekannt (Vanier, 2010). Somit zählt diese Erkrankung zu den seltenen Erkrankungen. Die Mutation auf dem NPC1-Gen führt zu einer Cholesterinstoffwechselstörung, die über einen unbekannten Mechanismus zu einer progredienten Neurodegeneration, insbesondere der Purkinjezellen im Cerebellum, führt. Neben der Ablagerung von Cholesterin kommt es aber auch zur Ablagerung von Glycosphingolipiden, Sphingomyelin, Sphingosinen und speziell in Neuronen noch zu Gangliosid-Akkumulation. Die Krankheit führt immer zum Tode, da bis heute keine kurative Therapie existiert. Seit 2009 ist Miglustat als Medikament zugelassen, das jedoch lediglich eine Verzögerung der Erkrankung bewirkt. Über die Gangliosid-Akkumulation hinaus weisen beide Krankheiten, NPC und AD, die Entwicklung gleicher struktureller Neuropathologien auf, wie z.B. die Oligomerisierung und Fibrillenbildung von Amyloid-ß und Tau (Malnar et al., 2014). Die Bedeutung der neuronale Glycoshingolipid-Akkumulation als treibende Kraft der Neurodegeneration zeigte sich auch bei der Identifizierung einer genetischen Assoziation zwischen der Parkinson Erkrankung und der Gaucher Erkrankung (Sidransky et al., 2009).
Den Einfluss des Sphingolipidmetabolismus, dessen Signalweg und das Zusammenspiel der daran beteiligten Proteine auf Neurodegeneration ist zurzeit noch weitestgehend unverstanden. Bisherige Untersuchungen in der AG Bräuer zeigen, dass die S1P-Rezeptorexpression in NPC-/- Mäusen versus WT-Mäusen in der qRT-PCR verändert ist. Diese Daten sollen nun Ausgangspunkt für weitere detaillierte molekularbiologische und zellbiologische Studien sein, sowie dem Vergleich der Rezeptorexpression in NPC Mäusen versus AD Mäusen. Ein Fokus soll auf die Untersuchung von S1P3 und S1P5 liegen, da unsere Vorarbeiten eine Erhöhung der S1P3 mRNA und eine Verringerung der S1P5 mRNA Expression in NPC-/- Mäusen aufweisen.
Die Rolle von PRG5 in der Entwicklung der Dornfortsätze
Neuropsychiatrische Entwicklungsstörungen, wie Störungen aus dem Autismus Spektrum oder Schizophrenie, stehen im Zusammenhang mit abnormalen dendritischen Dornfortsätzen und der Entwicklung von Synapsen. Leider ist bisher wenig über die molekularen Mechanismen bei physiologischer als auch pathologischer Formation von dendritischen Dornfortsätzen bekannt. Das Ziel dieses Projektes ist die funktionelle Analyse eines neuen Kandidaten, PRG5 (Plasticity Related Gene 5), den wir vor Kurzen identifiziert haben, in seiner Rolle während der Entwicklung von dendritischen Dornfortsätzen. Im Einzelnen wollen wir die molekularen Mechanismen und Signalwege von PRG5 identifizieren und neu entdeckte Bindungspartner und deren Funktion im Prozess der Hirnalterung untersuchen. Wir wissen bereits dass der endogene PRG5 Proteingehalt eine Rolle in der korrekten Entwicklung von dendritischen Dornfortsätzen, ihrer Morphologie und der Stabilisierung von exzitatorischen Synapsen ausschlaggebend ist.
Zusätzlich konnten wir zeigen dass der C-Terminus von PRG5 an diesen Mechanismen, vermutlich durch lokale Lipidbindungen beteiligt ist. Aufgrund dessen das Veränderungen an Dornfortsätzen in vielen verschiedenen pathologischen Prozessen, inklusive neurodegenerative und neuropsychiatrische Erkrankungen gefunden wurden, könnte PRG5 hohe Relevanz haben in der Suszeptibilität, der Pathologie oder für die Therapie solcher Erkrankungen. Unsere Techniken kombinieren die Nutzung von transgenen Mausmodellen, primären Nervenzellkulturen und in vivo Manipulationen verschiedener Signalwege in der Maus durch die in utero Elektroporationstechnik. Diese hervorragende Kombination der Methoden wird es uns erlauben neue Signalwege zu identifizieren die in der Hirnentwicklung eine Rolle spielen, nicht nur für zelluläre Prozesse oder Netzwerkfunktionen, sondern auch krankhafte Veränderungen im Mausverhalten, dadurch werden wir ein vereinheitlichtes Bild bekommen wie neuropsychiatrische Entwicklungsstörungen entstehen.




