Das Universitätsinstitut für Medizinische Mikrobiologie und Virologie ist am Klinikum Oldenburg dafür zuständig, Infektionserreger nachzuweisen. Institutsleiter Axel Hamprecht beschreibt die Herausforderungen, vor denen er und sein Team derzeit stehen.
Herr Professor Hamprecht, wie hat sich Ihre Arbeit durch das Coronavirus verändert?
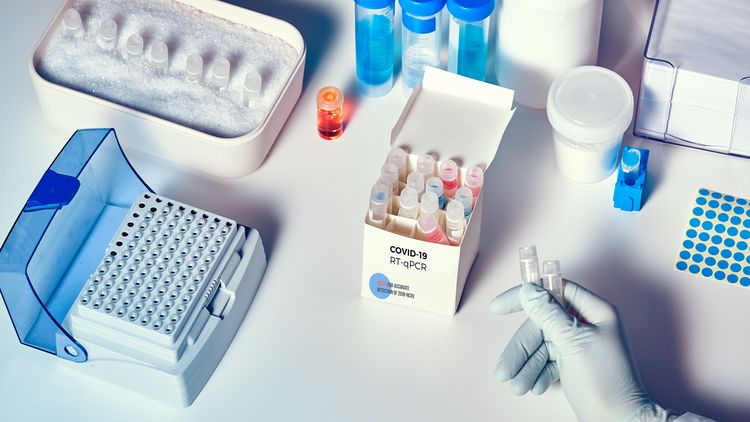
Tatsächlich hat Corona unseren Alltag vollkommen verändert. Die meisten Anfragen, die uns derzeit erreichen, betreffen den Nachweis von SARS-CoV-2 oder den Umgang mit Patienten. Wir haben in kurzer Zeit ein Testsystem aufgebaut, mit dem wir SARS-CoV-2 nachweisen können. Bei Proben von Patienten mit Infektionsverdacht müssen wir zudem besondere Sicherheitsmaßnahmen einhalten, was das Arbeiten sehr viel aufwendiger macht. Zuletzt haben wir unsere Arbeitszeiten verändert – wir arbeiten jetzt in drei getrennten Teams, wobei es zeitlich keine Überschneidungen gibt. So wollen wir verhindern, dass die Infektion eines Mitarbeiters das ganze Team lahmlegt.
Wie viele Tests führen Sie pro Tag durch?
Derzeit führen wir ungefähr 50 Tests pro Tag durch, wobei die Probenmenge jetzt noch steigen wird.
Können Sie kurz erläutern, wie das Testverfahren funktioniert?
Es ist ein molekularbiologischer Test, bei dem wir Nukleinsäuren des Virus nachweisen, also das virale Erbmaterial. Zuerst isolieren wir diese Nukleinsäuren aus der Patientenprobe, anschließend werden sie in mehreren Zyklen in einer Maschine vervielfältigt. Anhand von fluoreszierenden Farbstoffen lässt sich erkennen, ob der Test positiv ist oder nicht. Das Verfahren nennt sich „Echtzeit Reverse Transkriptase-Polymerase-Kettenreaktion“, im Englischen abgekürzt RT-PCR.
Der Schwerpunkt Ihrer Forschung liegt auf der Untersuchung von Antibiotikaresistenzen, dabei geht es zum Beispiel um die Verbreitung multiresistenter Bakterien, so genannter Krankenhauskeime. Wie unterscheidet sich die Bekämpfung von Viren und Bakterien?
Bakterien sind ziemlich einfach zu kultivieren und können mit einer Vielzahl von Methoden untersucht werden. In der Regel haben wir mehrere Antibiotika, die wirksam sind. Selbst bei multiresistenten Stämmen gibt es meist noch Reserveantibiotika, die eingesetzt werden können. Die Untersuchung von Viren erfolgt überwiegend über molekularbiologische Methoden, eine Virusanzucht findet heute nur selten statt und ist aufwendig. Leider haben wir nur sehr wenige Virustatika, also Wirkstoffe, die die Vermehrung von Viren hemmen und die wir für die Therapie von Infektionen einsetzen können. Für Coronaviren gibt es ein paar interessante Kandidaten – inwieweit diese klinisch einen Vorteil bringen, wird derzeit in Studien untersucht.
Welche Richtung halten Sie dabei für besonders erfolgversprechend?
Es gibt Remdesivir, ein Medikament, das ursprünglich gegen Ebola entwickelt wurde und zur Klasse der Nukleosidanaloga gehört. Das sind Wirkstoffe, die verhindern, dass das Erbmaterial der Viren in einer Zelle vervielfältigt wird. Gegen Ebola war es wenig wirksam, jedoch zeigt es in Laborstudien eine gute Wirksamkeit gegen SARS-CoV-2. Es gibt auch erste klinische Daten, überwiegend aus Einzelfallberichten, die zumindest vielversprechend aussehen. Ob Remdesivir so gut wirkt wie erhofft, wird man aber erst in einigen Monaten wissen, wenn Daten aus den größeren derzeit laufenden Studien verfügbar sind.
Wie schätzen Sie die Chancen ein, dass es in den nächsten Monaten gelingt, einen Virenhemmer gegen das Coronavirus zu finden?
Die größte Hoffnung setze ich derzeit in Remdesivir, weil hier die Entwicklung schon ziemlich weit ist und es kein ganz neues Medikament ist. Aber ich bezweifele, dass es in näherer Zukunft außerhalb von Studien für viele Patienten verfügbar sein wird. Es gibt auch andere Versuche mit bereits bekannten Medikamenten, die eigentlich für andere medizinische Indikationen entwickelt wurden. Dabei spricht man von „drug repurposing“, also der Nutzung eines bekannten Wirkstoffs für einen anderen Zweck. In Labortests wirken zum Beispiel Chloroquin, ein Malariamittel oder auch Teicoplanin, ein Antibiotikum, gegen Coronaviren. Man muss allerdings betonen: Inwieweit diese Substanzen wirklich therapeutisch einen Vorteil für Patienten mit COVID-19 bringen, ist derzeit noch unklar.
Interview: Ute Kehse